Système endo-lysosomal
Endosomes précoces
Rab5 et effecteurs
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Vue d'ensemble des endosomes précoces
- Devenirs des endosomes précoces
- Composants des endosomes précoces
- Rab5 et ses régulateurs
- Rab5 et ses effecteurs
- Complexes d'attache des endosomes précoces : complexe CORVET
- Complexe de tri et de recyclage des endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les effecteurs de Rab5, protéines qui répondent à Rab5 et impliquent au moins un de ses effets en aval, sont nombreux.
Les effecteurs essentiels de Rab5 sont (
- l'APPL1/2, impliqués dans les compartiments de tri des cargos, le trafic/signalisation membranaire et la prolifération cellulaire,
- l'EEA1 et la rabaptine-5, impliqués dans l'attache, la fusion et le tri des endosomes précoces,
- la rabénosyne-5, impliquée dans la régulation de la macropinocytose, l'initiation de l'endocytose tubulaire et l'aplatissement des surfaces membranaires,
- le ZFYVE21, impliqué dans le remodelage des phosphoinositides des membranes des endosomes précoces pour provoquer l'activation du signal et l'inflammation des tissus (ZFYVE21 is a complement-induced Rab5 effector that activates non-canonical NF-κB via phosphoinosotide remodeling of endosomes 2019),
- la rabankyrine-5, impliquée dans la formation des endosomes et le remodelage de la membrane plasmique apicale (The Rab5 Effector Rabankyrin-5 Regulates and Coordinates Different Endocytic Mechanisms 2004 et Tubular endocytosis drives remodelling of the apical surface during epithelial morphogenesis in Drosophila 2014),
- le complexe PI3KCIII-C2 qui produit PI(3)P, essentiel à la poursuite de la maturation des endosomes.
Les endosomes précoces et Rab5 favorisent le recrutement d'autres protéines.
Endosomes initiaux et APPL1
APPL1 (Adaptor protein containing a Pleckstrin-homology (PH) domain, Phosphotyrosine binding (PTB) domain, and Leucine zipper motif1) est localisé dans un sous-ensemble d'endosomes Rab5-positifs, appelés pré-EE, VEE (Very Early Endosomes), endosomes initiaux ou parfois, vésicules entrantes.
Structure d'APPL1
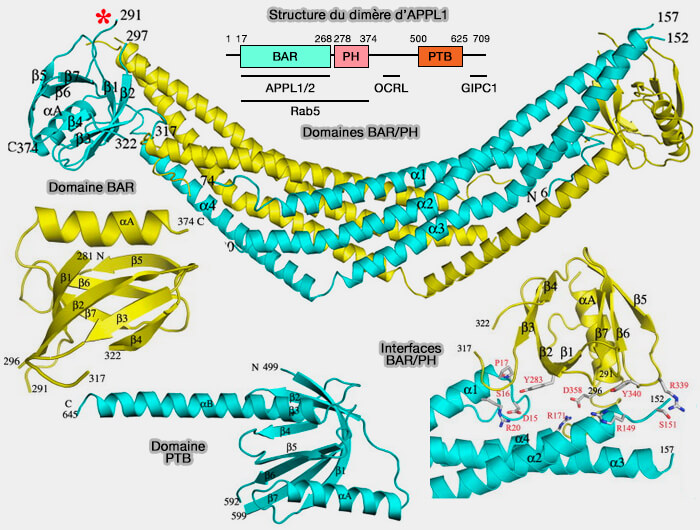
APPL1, composé de 709 résidus, comprend plusieurs domaines (APPL1 is a Multi-Functional Endosomal Signaling Adaptor Protein 2017).
1. Le domaine BAR N-terminal :
- détecte et induit la courbure des membranes (
rôle des protéines BAR),
- permet aussi l'oligomérisation de APPL1, aussi bien homodimérisation que hétérodimérisation avec APPL2 (Membrane Targeting by APPL1 and APPL2: Dynamic Scaffolds that Oligomerize and Bind Phosphoinositides 2007).
2. Le domaine PH central se lie à tous les phosphoinositides membranaires, excepté semble-t-il PI(4,5)P2 ou PIP2 (Crystal Structures of the BAR-PH and PTB Domains of Human APPL1 2007).

APPL1 est unique parmi les protéines BAR, i.e. les domaines BAR et PH de APPL1 forment ensemble un domaine fonctionnel qui se lie à la petite GTPase Rab5, i.e. des mutations dans l'un ou l'autre domaine inhibe cette interaction.
(Figure : vetopsy.fr d'après Li et coll)
3. Le domaine PTB (PhosphoTyrosine-Binding domain) C-terminal interagit avec de nombreux récepteurs et protéines de signalisation (
APPL1, par son domaine C-terminal, se lie, entre autres, avec le domaine PDZ de GIPC (GAIP-interacting protein C terminus, member 1), protéine impliquée dans le chargement et le transport des cargos sur les vésicules grâce à son interaction avec la myosine VI (The PDZ Protein GIPC Regulates Trafficking of the LPA1 Receptor from APPL Signaling Endosomes and Attenuates the Cell’s Response to LPA 2012).
Localisation d'APPL1
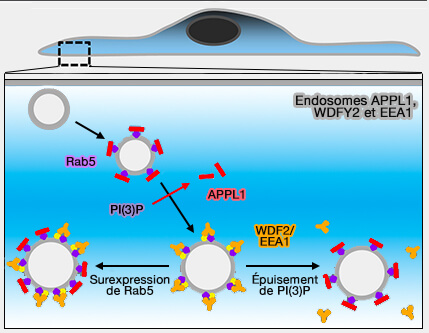
APPL1 se trouve dans des compartiments transitoires et très précoces dans la voie endocytaire, compartiments précurseurs des endosomes contenant EEA1 (Biochemical Characterization of APPL Endosomes: The Role of Annexin A2 in APPL Membrane Recruitment 2011).
(Figure : vetopsy.fr d'après Zoncu et coll)
1. APPL1 et EEA1, bien que tous deux effecteurs de Rab5, semblent peu colocalisés sur les endosomes précoces (A phosphoinositide switch controls the maturation and signaling properties of APPL endosomes 2009).
- EEA1 est en concurrence avec APPL1 pour la liaison de Rab5 sur les endosomes.
- Lors d'un changement de phosphoinositides, i.e. passage à PI(3)P, on ne retrouve plus APPL1.
Un autre effecteur de Rab5, WDFY2 (WD Repeat et FYVE Domain Containing 2), colocalise partiellement avec APPL1 et EEA1 (The WD40 and FYVE domain containing protein 2 defines a class of early endosomes necessary for endocytosis 2006).
- Après la perte d'APPL1, les compartiments WDFY2 ont fusionné pour former des endosomes plus gros, qui ont ensuite acquis EEA1 et perdu WDFY2.
- La perte de WDFY2 peut provoquer des cancers (WDFY2 restrains matrix metalloproteinase secretion and cell invasion by controlling VAMP3-dependent recycling 2019).

Toutefois, on trouve des endosomes APPL1/EEA1, i.e. un sous-ensemble d'endosomes APPL1 mûrit très probablement en et/ou échange de manière bidirectionnelle des cargos avec des endosomes EEA1,
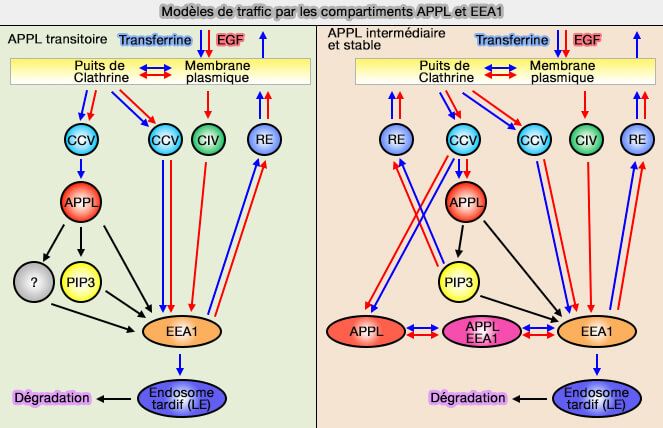
(Figure : vetopsy.fr d'après Kalaidzidis et coll)
2. Toutefois, un sous-ensemble d'endosomes APPL1 constitue un compartiment endosome précoce distinct qui peut être très stable (APPL endosomes are not obligatory endocytic intermediates but act as stable cargo-sorting compartments 2015).

Ces endosomes initiaux jouent un rôle dans le recyclage rapide des cargos vers la membrane plasmique.
APPL1 est lié au trafic d'EGFR en modulant l'activation de Rab5.
- L'EGFR est rapidement internalisé après activation par l'EGF, de manière Rab5-dépendante.
- Ensuite, il est acheminé vers des endosomes de recyclage ou des lysosomes pour la dégradation.
La surexpression d'APPL1 diminue l'activation de Rab5 et inhibe par la suite l'internalisation de l'EGFR, ce qui réduit la dégradation du récepteur. À l'inverse, l'épuisement d'APPL1 augmente l'activation de Rab5, entraînant une internalisation et un trafic accru d'EGFR vers les lysosomes pour réguler les niveaux de protéine EGFR et la signalisation.
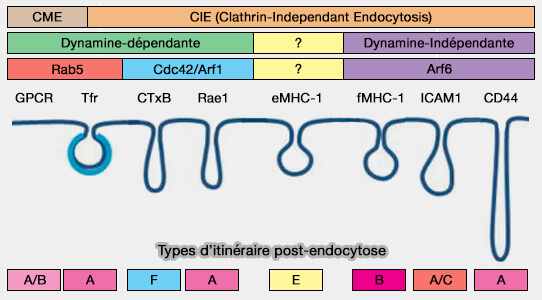
(Figure : vetopsy.fr d'après Mahmutefendic et coll)
APPL1 est lié au trafic du récepteur de la transferrine (TfR).
- Or, une fraction substantielle (environ 40%) du récepteur de la transferrine (TfR) intériorisé ne se colocalise pas avec APPL1 ou EEA1 à des moments précoces après l'internalisation (APPL endosomes are not obligatory endocytic intermediates but act as stable cargo-sorting compartments 2015).
- Les endosomes APPL1 ne sont donc pas le seul site d'entrée des puits recouverts de clathrine, car une fraction importante n'acquiert pas APPL1 après le déshabillage (A Phosphoinositide Switch Controls the Maturation and Signaling Properties of APPL Endosomes 2009).
APPL1 est lié au trafic des récepteurs couplés aux protéines G (GPCR).

APPL1 est un régulateur important du trafic endocytaire, et d'autres études seront nécessaires pour révéler les mécanismes par lesquels APPL1 régule le trafic d'une variété de récepteurs.
EEA1

La protéine d’attache EEA1 (Early Endosomal Autoantigen 1), protéine dimérique coiled-coil (superhélice), permet l’attache des endosomes précoces, rapprochant physiquement les endosomes et aboutissant finalement à la fusion et à la livraison du cargo endosomal.
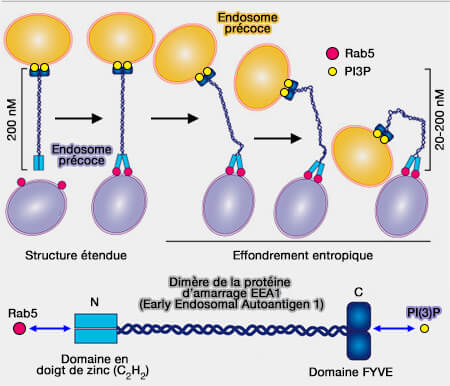
(Figure : vetopsy.fr d'après Das et coll)
1. EEAA1 se lie (Structural basis for Rab GTPase recognition and endosome tethering by the C2H2 zinc finger of Early Endosomal Autoantigen 1 (EEA1) 2010) :
- au PI(3)P membranaire via un motif en doigt de zinc dit canonique C2H2 de son extrémité N-terminale,
- à Rab5/GTP, via le domaine FYVE de son extrémité C-terminale (The FYVE Domain of Early Endosome Antigen 1 Is Required for Both Phosphatidylinositol 3-Phosphate and Rab5 Binding: CRITICAL ROLE OF THIS DUAL INTERACTION FOR ENDOSOMAL LOCALIZATION 2000).
Remarque : Rab5 interagit aussi avec le domaine WD40 de Vps15/p150 du complexe PI3KCIII-C2 pour produire et maintenir PI(3)P dans la membrane des endosomes précoces.
2. Rab5 induit un changement de flexibilité de l'EEA1.
Cette modification génère une force d'effondrement entropique qui tire la vésicule capturée vers la membrane cible et rapproche ainsi les deux compartiments pour initier la fusion (An endosomal tether undergoes an entropic collapse to bring vesicles together 2016 et Membrane Trafficking: An Endosome Tether Meets a Rab and Collapses 2016).
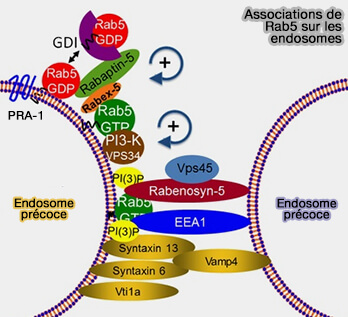
(Figure : vetopsy.fr d'après Zerial lab)
3. Rab5 est maintenue active sur les membranes grâce à sa GEF Rabex-5, elle-même positivement régulée par son interaction avec la rabaptine-5, effecteur de Rab5 et par EEA1.
Ce processus recrute Rab5, mais aussi la phosphatidylinositol kinase Vps34, faisant partie des complexes PIK3C3, qui augmente les niveaux de PI(3)P sur les membranes endosomales précoces.
Cette concentration accrue de PI(3)P sur les endosomes précoces est l'un des facteurs critiques pour la maturation endosomale précoce.

Cette boucle d’activation positive, dépendante de Rabex-5, recrute et maintient Rab5 sur la membrane des endosomes précoces.
3. En outre, EEA1 interagit avec les protéines SNARE (Soluble N-éthylmaleimide-sensitive-factor Attachment protein REceptor), comme la syntaxine 13 (Stx13) dans les endosomes précoces, principaux responsables de la fusion membranaire et du trafic membranaire au sein des cellules eucaryotes (Oligomeric Complexes Link Rab5 Effectors with NSF and Drive Membrane Fusion via Interactions between EEA1 and Syntaxin 13 1999 et The early endosome: a busy sorting station for proteins at the crossroads 2010)

La fusion vésiculaire est traitée, plus en détail, avec les protéines SNARE.
Remarque : on trouve aussi sur les endosomes EEA1 la petite GTPase Rab7a et son GAP TBC1D5 (
Rabénosyne 5
La rabénosyne 5 (Rbsn5), une autre protéine effectrice de Rab5, peut aussi se lier aux phosphoinositides via son domaine FYVE (Common and distinct roles for the binding partners Rabenosyn-5 and Vps45 in the regulation of endocytic trafficking in mammalian cells 2011).
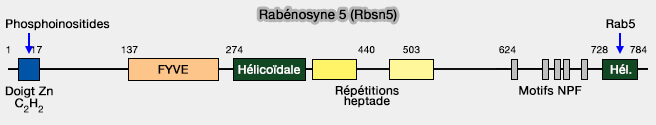
(Figure : vetopsy.fr d'après Eathiraj et coll)
1. Elle recrute sur les endosomes précoces Vps45, protéine de la famille Sec1/Munc18 qui régulent l’activité des protéines SNARE et facilitent ainsi les événements de fusion (Structural basis of family-wide Rab GTPase recognition by Rabenosyn-5 2005 et Munc18-1 is crucial to overcome the inhibition of synaptic vesicle fusion by α-SNAP 2019 et Endosome maturation factors Rabenosyn-5/VPS45 and caveolin-1 regulate ciliary membrane and polycystin-2 homeostasis 2018).
2. La perte de VPS45 provoque une mauvaise conversion Rab5/Rab7 entraînant le piégeage des cargos dans les endosomes précoces et une altération de la livraison aux lysosomes (Mammalian VPS45 orchestrates trafficking through the endosomal system 2021).
3. La déplétion de la rabénosine 5 provoque une dilatation des endosomes précoces et empêche, par exemple, le récepteur de la transferrine (TfR), d'atteindre l'ERC (Endocytic Recycling Compartment).
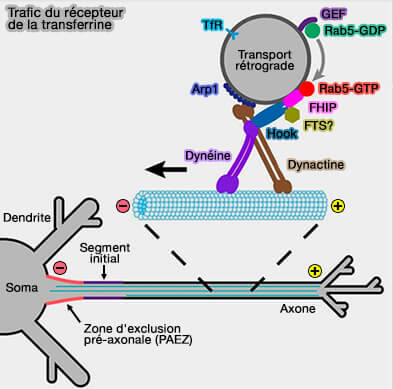
(Figure : vetopsy.fr d'après Guo et coll)
a. En effet, elle est considérée comme un effecteur double pour Rab4 et Rab5 (Rabenosyn-5 defines the fate of the transferrin receptor following clathrin-mediated endocytosis 2012).
b. Elle interagit avec les protéines EHD (EH domain-containing protein) EHD1 et EHD3, impliquées dans (
- dans la génération des tubules avec MICAL-L1 et la syndapine 2 (
biogenèse des endosomes de recyclage),
- mais peut-être aussi dans la courbure et la fission des vésicules contenant des rétromères au niveau des endosomes précoces.
Autres effecteurs de Rab5
On trouve d'autres effecteurs de Rab5.
FHF (Fused Toes), par exemple, composé de sous-unités FHIP, Hook (et FTS ?) est impliqué dans le transport rétrograde des endosomes précoces, en particulier dans le transfert du récepteur de la transferrine (
Complexe d'attache des endosomes précoces : complexe CORVET
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


