Domaines protéiques
Domaines protéiques d'interaction membranaire
Domaines BAR : rôles et régulation

Les membres de la superfamille des protéines à domaine BAR, qui se lient aux différentes membranes pour les incurver selon différentes courbures, sont engagés dans de nombreux processus.
(Figure : vetopsy.fr d'après Mc Mahon et coll)

Les courbures membranaires et leurs mécanismes sont étudiés dans des chapitres spécifiques.
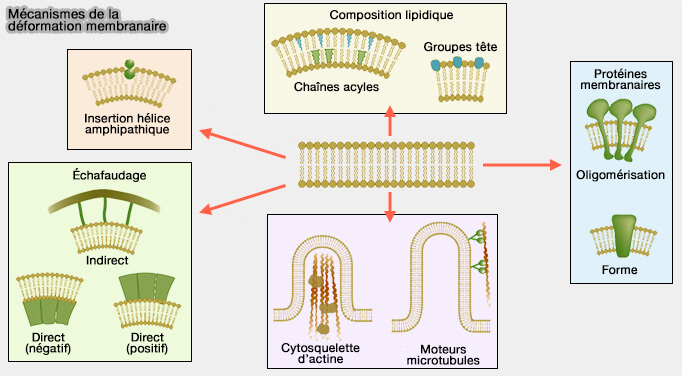
Courbure membranaire et domaines BAR
Vue d'ensemble
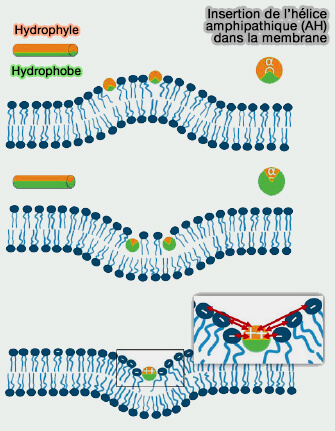
1. Les domaines BAR se dimérisent pour courber la membrane par des mécanismes d'enfoncement d'un " coin " (wedging mechanism) grâce à une hélice amphipathique (AH).

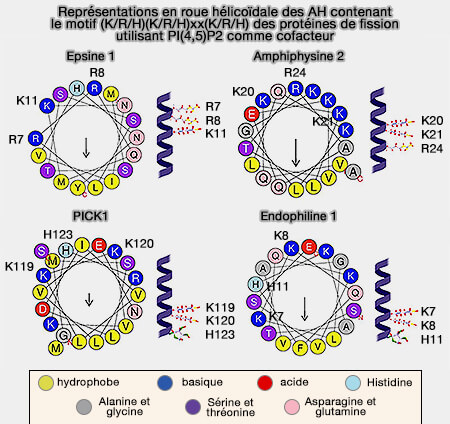
L'insertion des hélices amphipatiques (AH) de différentes familles de protéines dans les membranes est étudiée dans un chapitre spécifique.
L'insertion peu profonde de l'AH, i.e. environ 40% de l'épaisseur de la monocouche, comme celle des N-BAR, est particulièrement efficace dans la génération de la courbure de la membrane et semble-t-il suffisante pour provoquer la fission membranaire (
(Figure : vetopsy.fr d'après Zhukovsky et coll)
Cette insertion nécessite un ou deux lipides spécifiques pour générer une courbure membranaire (
2. Mais les domaines BAR ont aussi d'autres fonctions.
- IIs stabilisent les courbures générées par des mécanismes d'échafaudage (scaffolding mechanism) : des résidus du dimère chargés positivement interagissent avec la bicouche de lipides chargés négativement de la membrane (Structural Basis of Membrane Invagination by F-BAR Domains 2008) et contraignent la forme de la membrane en la stabilisant.
- Ils détectent également la courbure de la membrane afin de recruter d'autres facteurs cytosoliques (ayant aussi parfois des domaines BAR) pour lui permettre de prendre une forme ou une taille particulière.

Ces différents processus vont souvent de pair et induisent un feed-back positif entre différentes protéines à domaine BAR qui peuvent agir localement ou à grande distance.
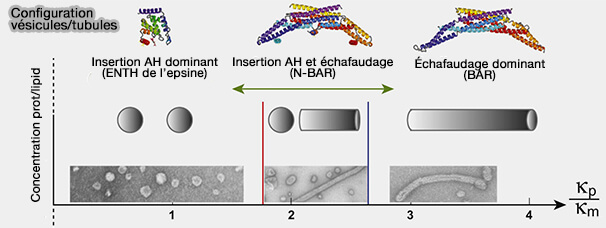
Scission (vésicules) versus échafaudage (tubules)
L'antagonisme entre hélices amphipathiques et échafaudages de domaine BAR régule probablement les événements de fission membranaire qui représentent la dernière étape de la formation des vésicules intracellulaires.
(Figure : vetopsy.fr d'après Boucrot et coll)

Vous pouvez lire : Membrane Fission Is Promoted by Insertion of Amphipathic Helices and Is Restricted by Crescent BAR Domains (2012).
1. Il semblerait qu'un grand nombre d'insertion d'hélices amphipathiques augmente la vésiculation au détriment de la tubulisation.
(Figure : vetopsy.fr d'après Jin et coll)
a. Dans le vésicules, l'insertion membranaire peu profonde d'une hélice amphipathique élargit le feuillet respectif de la bicouche membranaire et induit une courbure locale positive de la membrane.
- Le col membranaire qui relie la vésicule naissante à la membrane mère a des courbures à la fois négatives et positives.
- L'insertion d'hélices amphipathiques déstabilise la région membranaire et favorise le processus de scission.
b. Il semble que la première insertion d'une AH à partir d'une protéine capable de détecter la courbure de la membrane, i.e. de se lier sélectivement aux membranes courbes, favorise l'insertion d'AH supplémentaires, comme Sar1 (Sar1 GTPase Activity Is Regulated by Membrane Curvature 2016)
2. Par contre, une couche de protéines BAR enroulée autour du cou d'une membrane tubulaire stabilise la région et contrecarre la scission.
Le nombre de protéines pourrait aussi courber la membrane par encombrement stérique (
La pression stérique parmi les domaines désordonnés de l'amphiphysine 1 jouerait un rôle dans la fission (BAR scaffolds drive membrane fission by crowding disordered domains 2019).
3. La profondeur de l'insertion membranaire joue un rôle.
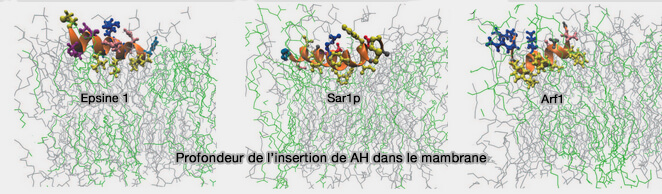
(Figure : vetopsy.fr d'après Mc Mahon et coll)
a. Lors de la formation de vésicules, la pénétration membranaire de l'hélice de l'endophiline est faible et la surface concave du domaine BAR ne pénètre pas profondément à l'intérieur de la chaîne acyle de la membrane (Roles of Amphipathic Helices and the Bin/Amphiphysin/Rvs (BAR) Domain of Endophilin in Membrane Curvature Generation 2010).

L'insertion de l'hélice H0 et l'insertion faible de la région centrale génèrent probablement une force de division entre lipides voisins favorisant ainsi la vésiculation.

par phosphorylation
(Figure : vetopsy.fr d'après Ambroso et coll)
b. Par contre, sur les tubules, l'hélice H0 et la région centrale de l'insert sont profondément insérées dans la région de la chaîne acyle de la bicouche lipidique et le domaine BAR est en contact avec les groupes de tête lipidiques (Endophilin A1 induces different membrane shapes using a conformational switch that is regulated by phosphorylation 2014).

L'immersion plus profonde des domaines BAR leur permet de constituer un échafaudage pour les tubules par contacts avec les lipides et par l'interoligomérisation des dimères.
Il semblerait que le passage entre l'activité tubulante et vésiculatrice de l'endophiline A1 est probablement régulé par la phosphorylation de S75 localisée dans la région d'insertion centrale du domaine BAR, i.e. phosphorylation par LRRK2, une kinase, qui subit une mutation dans la maladie de Parkinson.

Le mécanisme moléculaire qui se déroule dans la fission induite par l'amphiphysine et l'endophiline est encore à l'étude (
Liaisons au cytosquelette
1. De nombreuses molécules à domaine BAR lient la membrane au cytosquelette et favorisent la polymérisation de l'actine (BAR domain proteins—a linkage between cellular membranes, signaling pathways, and the actin cytoskeleton 2018).
- Des protéines à domaine BAR se lient et activent les NPF (WASP/WAWE) et provoquent la dimérisation de leur domaine VCA qui est un puissant activateur du complexe Arp2/3.
- D'autres sont des effecteurs ou des régulateurs des GTPases de la famille Rho.

(Figure : vetopsy.fr)
a. Par exemple, dans les neurones, l'endophiline recrute la synaptojanine, i.e. une PI 5-phosphatase qui régule PI(3,4,5)P3 ou PIP3 et la dynamine.
- La synaptojanine a un rôle essentiel dans la formation et le déshabillage des vésicules de clathrine (CCV).
- La synaptojanine déphosphoryle le 5-phosphate 5 du PI(3,4,5)P3 ou PIP3 et du PI(4,5)P2 ou PIP2.
Elle intervient également dans les podocytes, i.e. cellules épithéliales du glomérule rénal (Role of dynamin, synaptojanin, and endophilin in podocyte foot processes 2012).
b. D'autres se lient à l'actine directement pour former des réseaux.

Pour une revue de ces protéines chez l'homme, voir The BAR Domain Superfamily Proteins from Subcellular Structures to Human Diseases (2012).
Par exemple, DNMBP (DYNamine Binding Protein ou Tuba) présente toutes ces fonctions par sa composition.
- Ses quatre domaines SH3 N-terminaux se lient à la dynamine.
- Son domaine RhoGEF interagit avec Cdc42 (Tuba, a Cdc42 GEF, is required for polarized spindle orientation during epithelial cyst formation 2010).
- Son domaine BAR et ses deux domaines SH3 C-terminaux se lient directement à N-WASP et aux Ena/VASP.
DNMBP est associée à la maladie d'Alzheimer (Tuba, a Novel Protein Containing Bin/Amphiphysin/Rvs and Dbl Homology Domains, Links Dynamin to Regulation of the Actin Cytoskeleton 2003).
Rôles
Les rôles des protéines BAR sont multiples et elles sont mises en cause dans certaines maladies génétiques ou les cancers (F-BAR family proteins, emerging regulators for cell membrane dynamic changes—from structure to human diseases 2015).
1. Les protéines BAR sont des acteurs clés de l'endocytose, qu'elle fasse intervenir des microtubules ou des vésicules :

(Figure : vetopsy.fr d'après Boucrot et coll)
2. Elles sont essentielles à la formation des vésicules intracellulaires, i.e. du système endomembranaire.
C'est le cas, par exemple, des endosomes dans lesquels les vésicules d'endocytose fusionnent pour relarguer leur contenu.
3. Les protéines BAR interviennent aussi dans la formation :
- des tubules T (pour tubule transverse ou T-tubule), invaginations profondes du sarcolemme, permettant de conduire rapidement le potentiel d’action jusqu’au cœur de la cellule,
- des podosomes, invaginations de la surface de certaines cellules (macrophages) à l'intérieur de laquelle se trouvent des allongements en forme de doigts (Les podosomes endothéliaux 2009 ),
- des filopodes, projections cytoplasmiques minces qui s'étendent au-delà de la pointe de lamellipodes dans la migration cellulaire,
- des autophagosomes,
- des anneaux contractiles (cytokinèse)…
4. Elles participent à donner une forme aux mitochondries et aux autophagosomes.
Régulation

La régulation des protéines à domaine BAR est dépendante de petites GTPases (Rho…) qui agissent avec les phosphoinositides membranaires pour recruter des protéines cytoplasmiques.
Les GTPases coordonnent les interactions entre les protéines BAR, leurs cibles membranaires, de nombreuses protéines effectrices et les microfilaments d'actine.
La phosphorylation de résidus spécifiques des protéines BAR bloque la liaison aux lipides de la membrane et inhibe sa courbure. ou régule la vésiculation par rapport à la tubulation (
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


