Système endo-lysosomal
Phospholipides
- Vue d'ensemble du système endomembranaire
- Endosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les membranes des compartiments du système endo-lysosomal sont caractérisées par une composition différente des phosphoinositides.
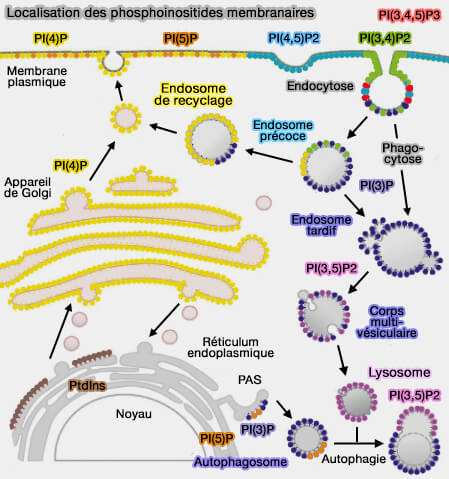
(Figure : vetopsy.fr d'après Cernikova et coll)
Ces phosphoinositides vont décider de l'emplacement des différents compartiments par leurs interactions avec (Phosphoinositide Diversity, Distribution, and Effector Function: Stepping Out of the Box 2017) :
- différents adaptateurs,
- des protéines motrices,
- le cytosquelette.
PI(3)P
Endosomes précoces
1. Les endosomes précoces contiennent en majorité du PI(3)P qui est l'un des facteurs critiques pour la maturation endosomale précoce (
1. La transition Rab5/Rab7 pour conduire aux endosomes tardifs les endosomes en maturation est induite par le recrutement médié par PI(3)P du complexe Mon1/Ccz1, GEF pour Rab7 (
PI(3)P recrute aussi les composants du complexe ESCRT, en particulier la protéine HRS de ESCRT-0, pour se préparer à la formation de vésicules intraluminales (ILV).
2. Rab5 interagit aussi avec le domaine WD40 de Vps15/p150 du complexe PI3KCIII-C2 pour produire et maintenir PI(3)P dans la membrane des endosomes précoces.
Endosomes tardifs
1. PI(3)P des endosomes tardifs :
- contribue à la formation de sites de contact membrane (MCS) du réticulum endoplasmique (RE) en engageant ORP1L et la protrudine par son domaine FYVE.
- facilite le transport antérograde (centrifuge) par sa liaison avec FYCO1 et Rab7.
2. Les nutriments stimulent l'activité catalytique de la phosphatidylinositol kinase Vps34/UVRAG, faisant partie des complexes PIK3C3, qui augmente les niveaux de PI(3)P (hVps34 Is a Nutrient-regulated Lipid Kinase Required for Activation of p70 S6 Kinase 2005).
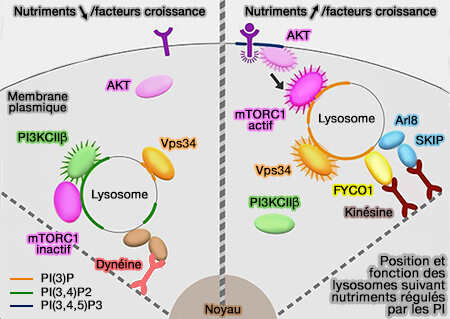
(Figure : vetopsy.fr d'après Wallroth et coll)
L'inhibition de Vps34 inhibe le trafic vers la périphérie cellulaire des endosomes tardifs et entraîne un regroupement périnucléaire même dans des conditions riches en nutriments (PtdIns3P controls mTORC1 signaling through lysosomal positionin 2017).

PI(3)P généré par Vps34 sur les membranes endosomales serait nécessaire au transport des lysosomes vers la périphérie cellulaire et à l'activation de mTORC1 dépendante du complexe protrudine/FYCO1/KIF5.
La privation de nutriments entraîne un recrutement sur l'endosome tardif de PIK3C2β, une phosphatidylinositol 3-kinases (PI3K) qui phosphoryle PI(3)P en PI(3,4)P2 provoquant un regroupement périnucléaire et la répression de l'activité de mTORC1 par l'association de Raptor avec les protéines inhibitrices 14-3-3 (mTORC1 activity repression by late endosomal phosphatidylinositol 3,4-bisphosphate 2017).
Lysosomes
1. En outre, PI(3)P augmente la tubulation des lysosomes (mTOR activates the VPS34–UVRAG complex to regulate autolysosomal tubulation and cell survival 2015).
- Il pourrait favoriser le recrutement de la spastizine qui, par son domaine FYVE, peut se lier sur des membranes distinctes ou des sous-domaines membranaires pour trier les cargos lysosomaux.
- PI(3)P pourrait assembler AP-5, la spastizine et le rétromère pour pouvoir recycler CI-MPR (Cation-Independent-Mannose 6-Phosphate Receptor), GOLM4 et GOLM1 des eendosomes tardifs ou des lysosomes vers l'appareil de Golgi (Role of the AP-5 adaptor protein complex in late endosome-to-Golgi retrieval 2018).
2. PI(4)P module un autre recyclage sur les lysosomes (
PI(3,5)P2
Endosomes tardifs
1. Une partie du PI(3)P membranaire des endosomes précoces laisse sa place à du PI(3,5)P2 lors de la transition avec les endosomes tardifs (Phosphoinositide conversion in endocytosis and the endolysosomal system 2018 et PtdIns(3,5)P2 is Required for Delivery of Endocytic Cargo into the Multivesicular Body 2003).
Cette conversion est catalysée par PIKfyve (phosphatidylinositol phosphates kinases, PIPKIII), recrutée par le PI(3)P via son domaine FYVE.
2. Des régulations négatives doivent intervenir, car aussi bien Rab7 que Rab5 peuvent activer Vps34 des PIKC3 pour produire du PI(3)P.
Maturation des endosomes tardifs et transport des lysosomes
1. La maturation des endosomes tardifs en lysosomes s'accompagne d'une conversion de PI(3)P en PI(3,5)P2 par la phosphatidylinositol phosphates kinases PIPKIII (Fab1//PIKfyve), retrouvé sous forme de complexe (PAS) dans ces deux compartiments.
- Ce processus active le canal calcique lysosomal TRPML1 qui augmente les niveaux de calcium cytosolique pour recruter ALG2, le capteur de Ca++ cytosolique.
- La formation du complexe TRPML1/ALG2/dynéine sur les membranes lysosomales induit le transport rétrograde (centripète) des lysosomes.
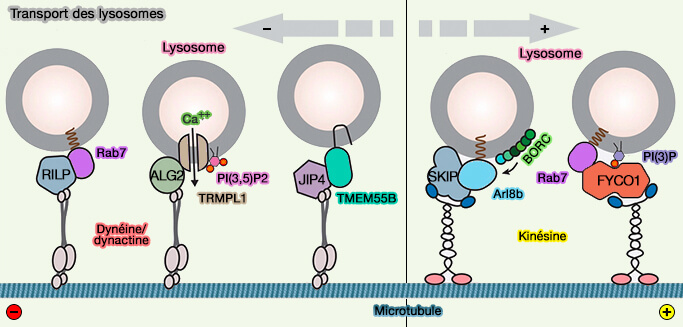
(Figure : vetopsy.fr d'après Cabukusta et Neefjes)

Le canal calcique lysosomal TRPML1, ainsi que tout ce qui touche au calcium lysosomal, est étudié dans un chapitre spécial.
2. L'activation de TRPML1 par le PI(3,5)P2 lysosomal peut être inhibée par le PI(3,4)P2 associé à l'autophagosome (Phosphoinositide isoforms determine compartment-specific ion channel activity 2012).
Fission lysosomale

Pikfyve contrôle la fission des lysosomes pour contrebalancer leur fusion, en régulant leur nombre et leur taille (
(Figure : vetopsy.fr d'après The LipidWeb)
PI(3,5)P2 se lie à la cortactine pour concurrencer l'interaction actine/cortactine, i.e. libère les filaments d'actine sur les endosomes, les mélanosomes et éventuellement les lysosomes (PI(3,5)P2 controls endosomal branched actin dynamics by regulating cortactin–actin interactions 2015).
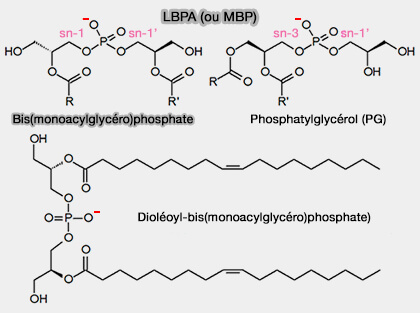
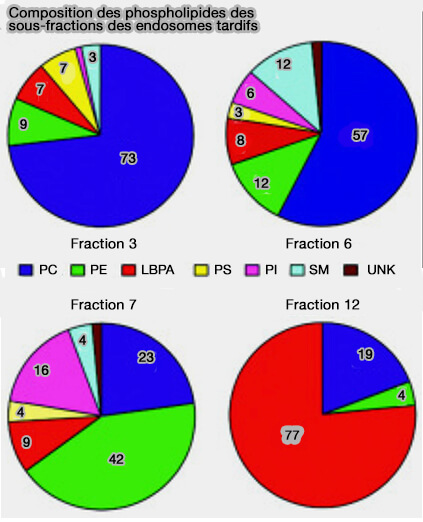
LBPA ou BMP
Les endosomes tardifs, contiennent, en plus du PI(3,5)P2, un phospholipide atypique, l'acide 2′2-dioléoyl lysobisphosphatidique (LBPA ou BMP, i.e. Bis(monoacylglycéro)-phosphate).

Pour tout savoir sur LBPA ou BMP, voit sa fiche sur The LipidWeb.
1. LBPA est retrouvé dans les endosomes tardifs, les endo-lysosomes et les lysosomes (Bis(monoacylglycero)phosphate Forms Stable Small Lamellar Vesicle Structures: Insights into Vesicular Body Formation in Endosomes 2009).
LBPA n'est pas détectable :
- dans les endosomes précoces dans lesquels la biogenèse des vésicules intraluminales (ILV) commence (Concerted ESCRT and clathrin recruitment waves define the timing and morphology of intraluminal vesicle formation 2018).
- dans les endosomes ou corps multivésiculaires (MVE/MVB) immatures ou intermédiaires.
(Figure : vetopsy.fr d'après Kobayashi et coll)
2. Les endosomes tardifs ou les endo-lysosomes contiennent des membranes internes d'origines diverses :
- des exosomes en formation,
- des ILV destinées aux lysosomes,
- des restes d'organites délivrés par autophagie (
vidéo de la complexité du sytème intraluminal).
LBPA lui-même semble être enrichi dans une sous-population de ces membranes intraluminales (Separation and Characterization of Late Endosomal Membrane Domains 2002).
PI(3)P et LBPA se localisent dans différentes populations d'ILV au sein des endosomes.
2. LBPA est un phospholipide non conventionnel non seulement en raison de sa distribution restreinte, mais aussi parce qu'il présente une stéréo-configuration unique sn-1-glycérophosphate-sn-1′-glycérol (sn-1: sn-1′) (Spectroscopic Evidence for the Unusual Stereochemical Configuration of an Endosome-Specific Lipid 2011).
- Le LBPA est donc un mauvais substrat pour la plupart des phospholipases et un candidat parfait pour résider dans l'environnement de dégradation des compartiments endocytaires tardifs.
- Toutefois, LBPA conserve des propriétés similaire aux autres phospholipides (Effects of the Endosomal Lipid Bis(monoacylglycero)phosphate on the Thermotropic Properties of DPPC: A 2H NMR and Spin Label EPR Study 2010).
3. LBPA pourrait être synthétisé dans le cytoplasme des endosomes tardifs à partir du phosphatidylglycérol (PG), PG trouvé dans les mitochondries, qui pourrait le rendre disponible par mitophagie.
PI(4,5)P2 ou PIP2
PI(4,5)P2 ou PIP2 est enrichi au niveau de la membrane lysosomale pour produire une tubulation des lysosomes lors de l'autophagie (
PI(4)P

PI(4)P est le phosphoinositide de l'appareil de Golgi.

(Figure : vetopsy.fr d'après Cernikova et coll)
1. PI(4)P semble inhiber la tubulation des lysosomes, éventuellement en recrutant les protéines de scission pour promouvoir la vésiculation (The lipid kinase PI4KIIIβ preserves lysosomal identity 2013).
L'élimination de la phosphatidylinositol 4-kinase PI4KIIIβ des lysosomes altère de manière significative la dynamique lysosomale dans des cellules au repos, i.e. les tubules sont plus nombreux et plus longs, en augmentant la concentration de clathrine et de l'AP-2 sur les lysosomes.
2. PI(4)P pourrait coordonner la courbure et l'élasticité membranaire pour produire de petites vésicules et inhiber la croissance des tubules.
- PI4K, AP-2 et la spastizine interagissent entre elles (Spastic paraplegia proteins spastizin and spatacsin mediate autophagic lysosome reformation 2014).
- L'élimination de PI(4,5)P2 ou PIP2 et sa conversion en PI(4)P obtenue par la synaptojanine 1 sur des sites à forte courbure pourrait coopérer avec la dynamine pour réaliser la fission membranaire (Synaptojanin 1-Mediated PI(4,5)P2 Hydrolysis Is Modulated by Membrane Curvature and Facilitates Membrane Fission 2011).
3. Dans une proposition de modèle, PI4K et PI(4)P aident à assembler la spatacsine/SPG11, la spastizine/SPG15, l'AP-5 et la dynamine pour vésiculer les bourgeons de clathrine.
En leur absence, le bourgeonnement se poursuit, produisant des tubules, probablement indépendamment des PI(4,5)P2.
Remarque : l'accumulation de PI(3,4)P2 sur les vésicules d'endocytose clathrine-dépendantes annoncerait leur déshabillage et entraînerait l'arrivée de la petite GTPase Rab5, régulateur principal de la dynamique des endosomes précoces.
PIP et interactions endosomales
Le recrutement par les PIP nécessite le plus souvent une interaction de domaines protéiques solubles avec des groupes de tête lipidiques (
Rab et effecteurs
Nous donnerons quelques exemples de Rabs ou d'Arl/Arf et de leurs effecteurs qui peuvent avoir des domaines interagissant avec les phosphoinositides qui modulent leurs interactions avec les protéines motrices.
1. On retrouve le domaine PH dans les protéines effectrices de :
- Rab5, i.e. APPL1, la GAP ARMUS/TBC-2,
- Rab7 ou Arl8, i.e. SKIP (PLEKHM2),
- Rab8, i.e. les protéines Graf,
- Arf6, i.e. la GAP ACAP1.
Le domaine PH est aussi présent dans :
- le capteur de cholestérol ORP1L, associé à Rab7 (A non-canonical GTPase interaction enables ORP1L-Rab7-RILP complex formation and late endosome positioning 2018),
- la sous-unité EAP45/VPS36 de l'ESCRT-II.
2. On retrouve le domaine FYVE dans les protéines effectrices de :
- Rab5, i.e. EEA1 qui comprend aussi un motif en doigt de zinc dit canonique C2H2 dans son extrémité N-terminale,
- Rab7, i.e. la protrudine ou FYCO1, ce qui est curieux car ces deux composants font partie d'une même machine. Il semble que cette liaison, ainsi que leur capacité à se lier à Rab7, soit essentielle pour marquer un sous-ensemble défini d'endosomes/lysosomes tardifs.
Le domaine FYVE est aussi présent dans la protéine HRS, sous-unité de ESCRT-0 ou de pikfyve qui convertit PI(3)P en PI(3,5)P2.
3. On retrouve le domaine PX dans les nexines, qu'elles soient liées au rétromère canonique, i.e. SNX1/SNX2 et SNX5/SNX6, au rétromère/SNX3 et au rétromère/SNX27.
Protéines motrices
Certaines protéines motrices interagissent directement avec les phosphoinositides pour moduler leurs interactions.
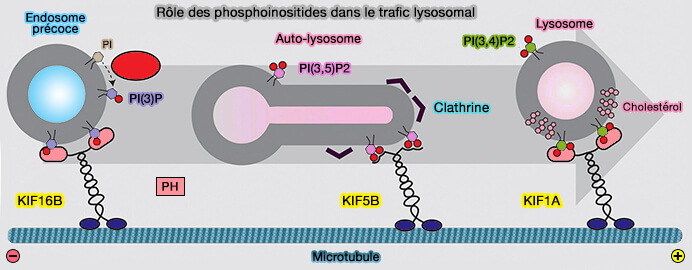
1. KIF16B, un membre de la famille des kinésines-3, interagit avec PI(3)P via son domaine PX.
De plus, le transport antérograde (centrifuge) des endosomes précoces par KIF16B nécessite PI(3)P généré par Vps34 (Modulation of Receptor Recycling and Degradation by the Endosomal Kinesin KIF16B 2005 et Adhesion force and attachment lifetime of the KIF16B-PX domain interaction with lipid membranes 2017).
(Figure : vetopsy.fr d'après Cabukusta et Neefjes)
2. KIF1A, un autre membre de la famille des kinésines-3, interagit avec PI(4,5)P2 ou PIP2 sur les vésicules pour faciliter le transport antérograde (centrifuge).
La formation de microdomaines lipidiques ordonnés par le cholestérol sur les vésicules entraîne une multiplication par 40 du trafic de KIF1A médié par PIP2 (Role of phosphatidylinositol(4,5)bisphosphate organization in membrane transport by the Unc104 kinesin motor 2002).
3. KIF5B interagit avec PI(4,5)P2 sur les membranes des autolysosomes et initie la tubulation des autophagosomes vers l'extrémité plus des microtubules pour former des protolysosomes.
- En effet, après la famine où la majorité des lysosomes fusionnent avec des autophagosomes pour créer des auto-lysosomes, on assiste à la reformation des lysosomes,
- Au cours de ce processus, la clathrine provoque un regroupement des lipides sur les membranes autophagosomales pour former des microdomaines enrichis en PI(4,5)P2 (Kinesin 1 Drives Autolysosome Tubulation 2016).
Ces observations suggèrent que non seulement la présence de protéines adaptatrices ou de lipides, mais aussi leur organisation spatiale au sein de la même vésicule peuvent dicter le trafic vésiculaire.
Retour aux endosomes
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


