Fusion membranaire : protéines SNARE
Protéines Qa-SNARE : syntaxines (Stx)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les syntaxines, Q-SNARE, i.e. contenant une glutamine (Q) dans la couche 0 du motif SNARE, sont des t-SNARE (t pour target, cible), et en particulier des Qa-SNARE, i.e. a, b et c indiquant leurs positions relatives dans le complexe SNARE.
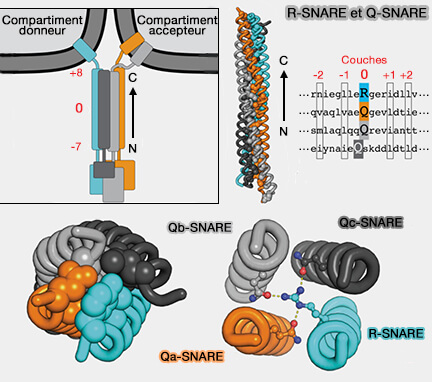
(Figure : vetopsy.fr d'après Baker et coll)
Les protéines SNARE forment quatre sous-familles conservées au cours de l'évolution :
- les v-SNARE (v pour vésiculaire), qui sont pour la plupart des R-SNARE,
- les t-SNARE (t pour target, cible) qui sont pour la plupart des Q-SNARE (
infos sur la nomenclature).
Structure
des syntaxines
Les syntaxines (Stx) sont de petites protéines composées de plusieurs domaines.
Structure de la
syntaxine 1 (Stx1)
Nous décrirons la structure de Stx1 impliquée dans la libération des neurotransmetteurs (
- Le peptide N-terminal (résidus 1-26), 5 et 16 interagit avec les protéines SM - Sec1/Munc18-like - (SNAREs and traffic 2005).
-
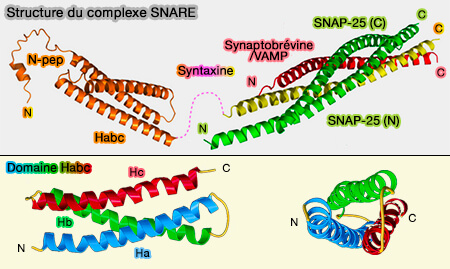
Structure du complexe SNARE et domaine Habc de Stx1
(Figure : vetopsy.fr d'après Stepien et coll) - Le domaine SNARE (147-187), appelé aussi H3, est le moteur crucial de la fusion, son interaction avec le domaine Habc inhibe la formation du complexe trans-SNARE (The Habc domain of syntaxin 3 is a ubiquitin binding domain 2020).
- Un lien (linker ou LD, juxtamembrane Linker Domain), i.e. 147-187, relie le domaine SNARE au domaine C-terminal.
- Le domaine transmembranaire (TM ou TMD) est un domaine d'ancrage C-membranaire terminal (TM ou TMD) qui amarre Stx1 sur la membrane présynaptique.
Structure des autres Stx)
1. Les syntaxines Stx2, Stx3, Stx4, Stx7, Stx12/13, Stx16, Stx17 et Stx18 ont une structure de base identique à Stx1.
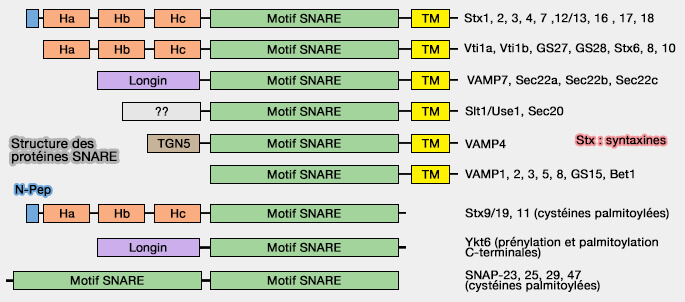
(Figure : vetopsy.fr d'après Hong et Lev)
2. Stx6, Stx8 et Stx10 ne possèdent pas de peptide N-terminal.
3. Stx9, Stx11 et Stx19 ne possèdent pas de domaine transmembranaire C-terminal, i.e. elles nécessitent une palmitoylation sur leurs multiples cystéines pour s'associer à la membrane plasmique.
Localisation et rôles des syntaxines
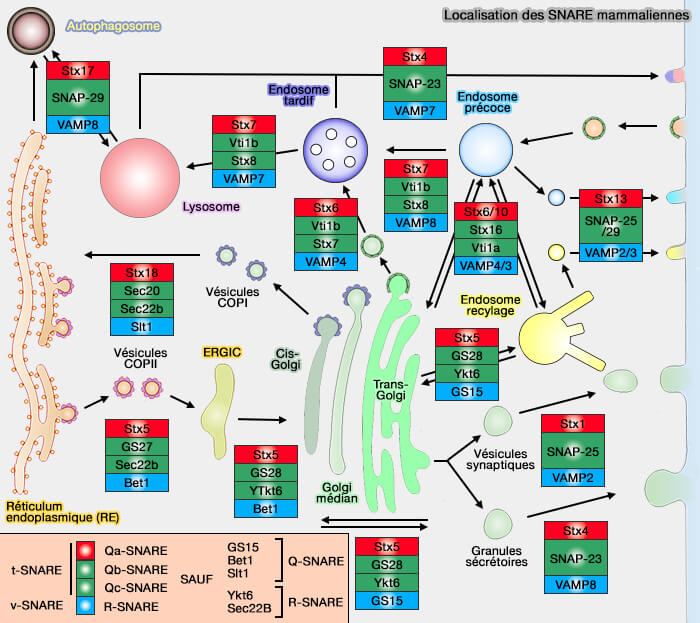
(Figure : vetopsy.fr)
| Syntaxines (Stx) mammaliennes |
Localisation | Distribution tissulaire |
Fonctions |
|---|---|---|---|
| Membrane présynaptique |
|
|
|
| Syntaxine 2A/B/C/D (épimorphine) |
Membrane plasmique |
Faible spécificité tissulaire |
|
| Syntaxine 3A/B/C/D | Membrane plasmique |
Rétine | Exocytose (neutrophiles) |
| Syntaxine 4 | Membrane plasmique |
Faible spécificité tissulaire |
Translocation Glut4 |
| Syntaxine 5 (courte et longue) |
|
Faible spécificité tissulaire |
|
| Syntaxine 6 |
|
Faible spécificité tissulaire |
|
| Syntaxine 7 |
|
Faible spécificité tissulaire |
|
| Syntaxine 8 | Endosomes | Faible spécificité tissulaire |
|
| Syntaxine10 | TGN | Faible spécificité tissulaire |
|
| Syntaxine 11 |
|
|
Trafic endosomes tardifs/TGN |
| Syntaxine 12/13 |
|
Faible spécificité tissulaire |
|
| Syntaxine 16A/B/C | Golgi/TGN | Faible spécificité tissulaire |
|
| Syntaxine 17 |
|
Faible spécificité tissulaire |
|
| Syntaxine 18 /Ufe1 |
|
Col de l'utérus | |
| Syntaxine 19 |
|
|
Transport endosomal d'EGFR |
Retour aux Q-SNARE
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


