Reproduction cellulaire
Cycle cellulaire et régulation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Matrice extracellulaire
- Reproduction cellulaire
- Biochimie
- Transport membranaire
- Moteurs moléculaires

Le cycle cellulaire est l'ensemble des modifications qu'une cellule subit entre sa formation par division à partir d'une cellule mère, et le moment où cette cellule a fini de se diviser en deux cellules filles.
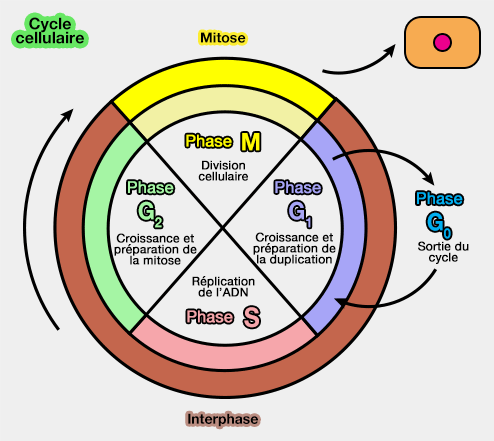
(Figure : vetopsy.fr d'après Zephris)
Le cycle cellulaire est retrouvé dans les deux types de reproduction cellulaire :
Nous n'allons pas traiter toutes les modifications structurelles ou moléculaires du sujet.

Pour cela, consultez l'excellent travail de Marie-Claude Lebart et Jean Mariani (Neurobiologie des Signaux Intracellulaires, UMR 7101, CNRS-UPMC) sur la régulation du cycle cellulaire.
Complexes cyclines-Cdk
Le cycle cellulaire comprend plusieurs phases et est sous la dépendance de complexes Cdk-Cyclines, formant des complexes hétéro-dimériques.
Les Cdk (Cycline-dependant-kinase) sont une famille de protéines de faible poids moléculaire : ce sont des sérine/thréonine kinases, c'est-à-dire qui catalysent le transfert d'un groupe phosphate PO43−, hautement énergétique).
avec la Cdk4 (jaune-rouge)
On en compte plusieurs types (plus d'une dizaine Cdk1, Cdk2…).

Par définition, les Cdk ont une activité kinase uniquement quand elles sont associées à une cycline.
Les cyclines sont une famille de protéines dont la présence varie en fonction de la phase du cycle cellulaire, d'ou leur nom : elles apparaissent et disparaissent brutalement à des moments précis du cycle, de façon périodique.
Il en existe une quinzaine différentes (Cycline A, Cycline B…) dont certaines sont orphelines de leur Cdk.
Pour la régulation du cycle cellulaire, on peut les classer (avec leur Cdk respective) en :
- cyclines G1/S, qui contrôlent le passage de la phase G1 à la phase S (transition G1/S),
- cyclines G2/M qui permettent la transition entre la phase G2 et la phase M : Cycline B/Cdk1.

Les différents complexes Cycline/Cdk agissent au cours du cycle cellulaire (régulation de la succession des quatre phases du cycle par les complexes Cyclines/Cdk).
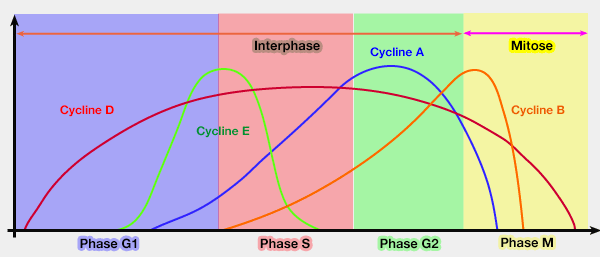
(Figure : vetopsy.fr)
Exemple du MPF
La multiplication cellulaire est sous le contrôle du MPF, facteur promoteur de la maturation, de la mitose ou de la phase M (mise en évidence), car il facilite le passage de la phase G2 à la phase M du cycle cellulaire.
La MPF a été découverte en étudiant le déblocage de la méiose II ovocytaire après la fécondation chez la grenouille, d'ou son nom de facteur de maturation.

Le MPF est composé de deux sous-unités : la cycline B et le Cdk1. Le Cdk1 est l'activateur essentiel, mais son activité est dépendante de la liaison avec sa cycline et d'autres régulateurs qui modifient sa conformation spatiale.
Propriétés de la Cdk1 (Cdc2)
La Cdk1 ou Cdc2 (cell division cycle protein 2 homolog) active la mitose en phosphorylant de nombreuses protéines (sérine/thréonine kinase).
Elle agit, entre autres, sur les histones, les lamines, présentes dans la membrane nucléaire, et la myosine cytoplasmique, ce qui permet la condensation de la chromatine, la dépolarisation de la membrane nucléaire et la création du fuseau de division (protéines-cibles).
La structure tridimensionnelle des Cdk est caractérisée (régulation de l'activité des Cdk) :
- par l'existence de deux sites de fixation :
- l'un pour la protéine-cible,
- l'autre pour l'ATP ;
- par la présence d'acides aminés phosphorylés ou non.
Pour être activée, la Cdk doit pouvoir fixer et la protéine-cible et l'ATP, et la conformation de ses sites peut être modifiée par :
- des activateurs (Cyclines, Cdc25, CAK),
- des inhibiteurs (Wee1, CKI comme la p16 de la famille Cip/kip qui se lie aux complexes Cycline/Cdk pour bloquer leur activité kinase et p21 de la famille INK qui empêche loa formation du complexe Cycline/Cdk ).
La structure spatiale des Cdk est également caractérisée par une boucle T et une hélice PSTAIRE qui masquent les sites d'action de l'activité enzymatique (boucle et hélice de la Cdk2).
Rôle dans l'entrée en mitose
Tout d'abord, si la Cdk n'est pas liée à la Cycline, le site de la Cdk est inaccessible pour l'ATP : le changement de conformation de la Cdk après liaison (action sur les boucles T et PSTAIRE), peut alors faire apparaître la thréonine 161, la thréonine 14 et la tyrosine 15 (lieu d'action des autres régulateurs) et provoque une modification du site pour l'ATP afin de mieux l'acceuillir.
La synthèse de Cycline B s'effectue pendant tout le cycle, mais elle est détruite pendant les phases M et S : sa concentration augmente graduellement de S à la fin de G2.

La synthèse et la dégradation des cyclines pendant le cycle cellulaire régule aussi l'activité enzymatique des Cdk.
1. Durant les phases G1 et S, la Cdk1 est inactivée.
- La Cdk1 est phosphorylée par la CAK (Cyclin-Activating-Kinase formée de Cycline H/Cdk7/Mat1 chez les metazooaires) sur la Thréonine 161. Le changement de conformation (déplacement de la boucle T) a ouvert le site pour la protéine-cible.
- Par contre, elle est aussi phosphorylée par Wee1 (qui est aussi une sérine/thréonine kinase), touchant la thréonine 14 et la tyrosine 15. Cette phosphorylation modifie le site sur lequel l'ATP pourrait se fixer, rendant ainsi l'activité kinase inefficace. Chez les metazooaires, on trouve, en plus de Wee 1 dans le noyau, Myt1 dans le cytoplasme.
La liaison de la P 21 à la cycline bloque le site de l'ATP, celle de la P16 inhibe la liaison avec la cycline.
2. Le passage de la phase G2 en M est provoquée par la déphosphorylation de la Cdk1 par Cdc25 (cell-division-cycle, de la famille des phosphatases).
- Cdc25, laisser libre à la fin de la phase S, pénètre dans le noyau et subit une activation (phosphorylation par la protéine POLO) : elle arrache le groupement phosphate de la thréonine 14 et de la tyrosine 15, permettant à l'ATP d'entrer dans son site, et donc d'activer la Cdk1.
- La Cdk1 phosphoryle alors la Cdc5 qui devient plus active sur la CdK1 (auto-activation).
- La Cdk1 phosphoryle aussi Wee1 et l'inactive (feed-back négatif). Ces deux phénomènes expliquent l'explosion de l'activitation de la Cdk1.
3. L'activation de la Cdk1 (donc du MPF) provoque l'entrée en mitose en phosphorylant un grand nombre de protéines (protéines-cibles de la Cdk1)

Il existe des mécanismes de surveillance pour contrôler les transitions G1/S, G2/M et métaphase/anaphase lorsqu'une anomalie est détectée (mécanismes de contrôles).
Vous pouvez suivre la suite de la régulation cellulaire sur le site de Marie-Claude Lebart et Jean Mariani.


