Domaines protéiques
Motifs à doigt de zinc (zinc-finger)
: structures et fonctions

Les motifs à doigt de zinc, avec un ou plusieurs ions Zn++, grâce à leur variabilité, ont de multiples fonctions dans la reconnaissance des protéines.
Structure de base
1. Le motif canonique à doigt de zinc (C2H2), d'une trentaine de résidus, est formé :
-
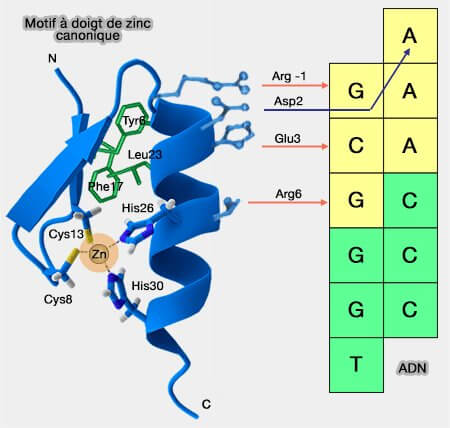
Motif canonique à doigt de zinc et liaisons avec l'ADN
(Figure : vetopsy.fr) - d'un domaine Zinc finger, qui reconnait les différents ligands (6-30),
- stabilisé par un ion Zn++ lié à une paire de cystéines (8 et 13) et d'histidines (26 et 30),
- comportant un coeur hydrophobe à trois autres résidus conservés : Tyr6 (ou Phe6), Phe17 et Leu23.
2. Le motif est composé :
- d'une extrémité N-terminale (" lateral flap "), qui contient les deux cystéines,
- d'un feuillet β (β sheet) à 2 brins antiparallèles formant une boucle (β-hairpin),
- d'une hélice α contenant les 2 histidines (Proposed structure for the zinc-binding domains from transcription factor IIIA and related protein 1988).
L'hélice α du domaine est insérée comme un " doigt " dans le grand sillon de l'ADN.
Différents groupes
1. Des variations sont possibles à partir de ce modèle canonique en fonction :
- du nombre d'atomes de zinc (Sticky fingers: zinc-fingers as protein-recognition motifs 2006),
- du nombre de cystéines, de 2 (canonique, Cys2His2 - C2H2 -) à 6,
- de la forme globale de la protéine dans le domaine plié, ce qui permet une classification plus précise à l'heure actuelle.
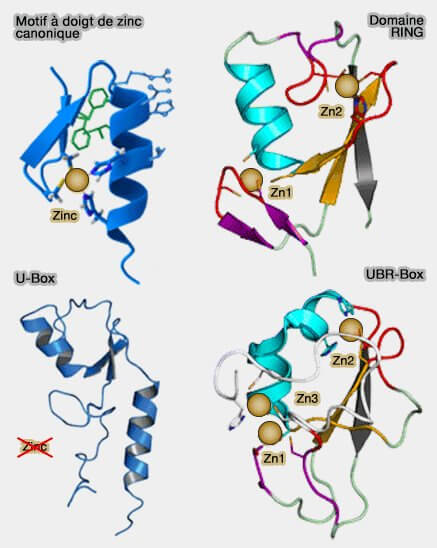
(Figure : vetopsy.fr)
2. On en compte 8 groupes :
- Cys2His2 canonique (C2H2) : deux ligands forment une articulation et deux autres forment l'extrémité C-terminale d'une hélice ;
- Gag knuckle : deux ligands forment une articulation et deux autres forment une hélice courte ou une boucle ;
- Treble clef (" clef de sol ") : deux ligands forment une articulation et deux autres forment l'extrémité N-terminale d'une hélice ;
- Zinc ribbon : deux ligands forment chacun deux articulations ;
- Zn2Cys6 : deux ligands forment l'extrémité N-terminale d'une hélice et deux autres forment une boucle ;
- TAZ2 domain like : deux ligands forment les extrémités des deux hélices ;
- Zn binding loop : quatre ligands forment une boucle ;
- metallothionein : une boucle riche en cystéine semble séquestrer les ions métalliques pour protéger l'environnement cellulaire.

Pour tout savoir sur la structure des motifs à doigt de zinc : SURVEY AND SUMMARY: Structural classification of zinc fingers (2003).
Reconnaissance des ligands
C'est l'hélice α qui reconnait les ligands, en particulier les ADN :
- par un contact primaire entre les résidus de l'hélice α-1, 3 et 6 (Arg, Glu, Arg) et un triplet de l'ADN (GCG dans son grand sillon) par des liaisons hydrogènes,
- par un autre contact entre le résidu 2 (Asp) et l'autre brin (The Discovery of Zinc Fingers and Their Applications in Gene Regulation and Genome Manipulation 2010).
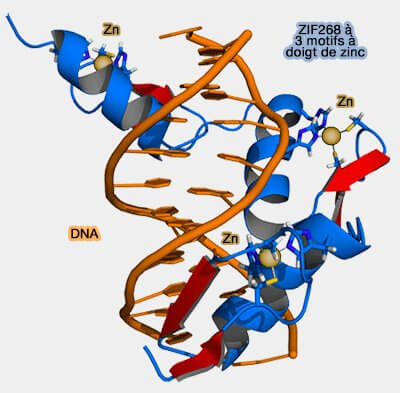
(Figure : vetopsy.fr d'après Splette)
Par contre, les motifs à doigt de zinc agissent toujours à plusieurs, en général en tandem, mais aussi en groupes comme pour les 9 de TFIIIA par exemple.
Fonctions
Les motifs à doigt de zinc, grâce à leur variabilité, ont de multiples fonctions dans la reconnaissance :
1. des acides nucléiques,
- dans la transcription et la régulation des ADN et des ARN (New Insights into DNA Recognition by Zinc Fingers Revealed by Structural Analysis of the Oncoprotein ZNF217 2013), comme par exemple pour GATA-1/FOG-1 (Zinc fingers as protein recognition motifs: structural basis for the GATA-1/friend of GATA interaction 2005) ou les domaines LIM,
- dans la régulation de la chromatine par les domaines PHD, par exemple ;
2. d'autres motifs protéiques surtout pour les enzymes impliquées dans (Sticky fingers: zinc-fingers as protein-recognition motifs 2006) :
- l'ubiquitination, comme les E3 ubiquitine ligases et les UBD de la classe des ZnF,
- la désubiquitination comme les DUB ;
3. dans les réponses à l'hypoxie cellulaire comme les domaines TAZ (Transcription Adaptor putative Zinc finger) ;
4. dans l'élaboration de protéines chimères, avec des nucléases ou intégrases, pour la modification du génome, à portée thérapeutique (The Discovery of Zinc Fingers and Their Applications in Gene Regulation and Genome Manipulation 2010).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


