Système endo-lysosomal
Endosomes de recyclage : Rab8
- Vue d'ensemble du système endomembranaire
- Endosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Rab8 est le régulateur principal régulateur des voies lentes de recyclage indépendantes de l'endocytose clathrine-dépendante (CME).
Le système de recyclage membranaire, complexe et hautement dynamique, comprend divers éléments membranaires dont le plus important implique la tubulation dynamique des membranes du système de recyclage.
Les endosomes de recyclage sont généralement enrichis en (The endocytic recycling compartment maintains cargo segregation acquired upon exit from the sorting endosome 2015) :
- en petites GTPases Rab, i.e. en particulier Rab11 et Rab8, mais aussi bien d'autres (
autres voies de recyclage),
- en petite GTPase Arf6,
- en protéines EHD (EH domain-containing protein) et/ou MICAL-L1 (Molecules Interacting with CasL-like 1).
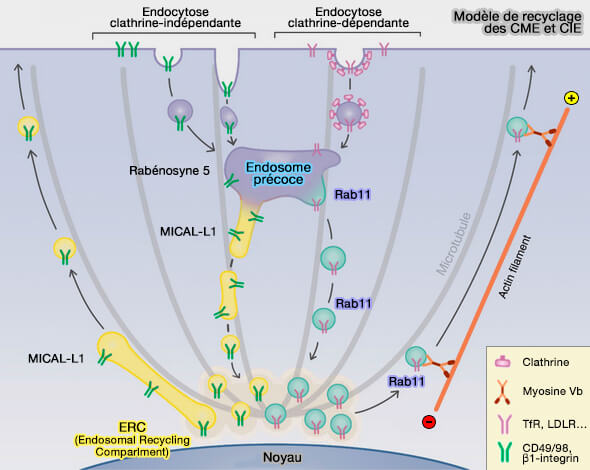
(Figure : vetopsy.fr d'après Xie et coll)
Rab8
1. Rab8a se distribue dans des endosomes tubulaires et vésiculaires qui recrutent également des protéines EHD (Myosin Vb Interacts with Rab8a on a Tubular Network Containing EHD1 and EHD3 2013).

La tubulation du système de recyclage dépendant de Rab8a est responsable du recyclage des vésicules par les endocytoses indépendantes de la clathrine (CIE).
Remarque : Rab8 est aussi présente au niveau des sites de contact membranaire (MCS) LD-LD pour la fusion des gouttelettes lipidiques (LD).
2. Rab8, comme d'autres Rab, fait intervenir d'autres molécules, en particulier :
- les protéines EHD,
- MICAL-L1.
Protéines EHD

Les protéines EHD sont étudiées dans un chapitre spécial.
La famille des protéines EHD possède un domaine EH (Eps15 Homology) localisé dans la région C-terminale de la protéine, contrairement aux autres protéines contenant le même domaine (EHD proteins: Key conductors of endocytic transport 2011).
- Elle comporte quatre membres, i.e. EHD1 à EHD4.
- Les EHD ont été liées à un certain nombre de petites GTPases Rab suggérant un rôle coordonné dans la régulation endocytaire (
tableau).

Les protéines contenant le domaine EH C-terminal ont été impliquées dans la courbure et la fission des endosomes, régulant ainsi le recyclage endocytaire, mais aussi dans l'endocytose cavéole-dépendante (
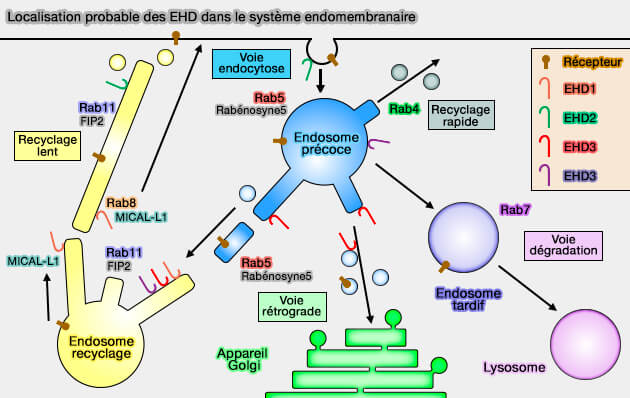
(Figure : vetopsy.fr d'après Naslavsky et coll)
Rôles des EHD
Les rôles des EHD sont différents dans les endosomes (Differential Roles of C-terminal Eps15 Homology Domain Proteins as Vesiculators and Tubulators of Recycling Endosomes 2013).
1. EHD1 régule la sortie des protéines du compartiment de recyclage endocytaire vers la membrane plasmique et a un rôle majeur dans la fission des endosomes de recyclage à l'ERC (Endocytic Recycling Compartment) ainsi que potentiellement aux endosomes précoces (Regulation of Synaptic Vesicle Budding and Dynamin Function by an EHD ATPase 2011).
(Figure : vetopsy.fr d'après Giridharan et coll)
EHD1, avec le rétromère et la dynamine 2, peut aussi interagir seul ou avec la rabankyrine 5, en amont des protéines de fission :
- des endosomes (
EHD1 et rétromère),
- des mitochondries pour réguler l'homéostasie mitochondriale (
EHD1 et homéostasie mitochondriale).
2. EHD2 est impliqué dans le contrôle des structures cavéolaires et, avec le domaine BAR contenant le partenaire de liaison syndapine/PACSINe2, stabilise les cavéoles à la surface cellulaire.

EHD2 est étudiée dans un chapitre spécial.
2. EHD3 et EHD4 jouent un rôle dans le transport des endosomes précoces vers les endosomes de recyclage.
Structure
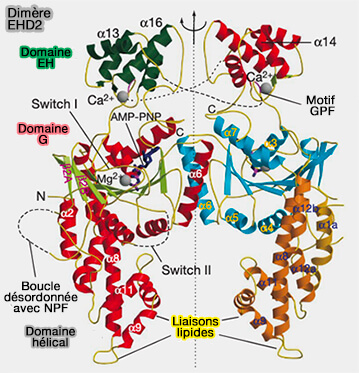
(Figure : vetopsy.fr d'après Daumke et coll)
EHD1 et EHD3, 86% d'homologie, s'homo- et s'hétérodimérisent et se co-localisent partiellement aux endosomes de recyclage (EHD3 Protein Is Required for Tubular Recycling Endosome Stabilization, and an Asparagine-Glutamic Acid Residue Pair within Its Eps15 Homology (EH) Domain Dictates Its Selective Binding to NPF Peptides. EHD3 Stabilizes Tubular Recycling Endosomes 2016).

La structure des EHD est étudiée dans un chapitre spécial.
1. Bien qu'ils possèdent un domaine GTPase (domaine G) comme celui de la dynamine, les EHD se lient à l'adénine plutôt qu'à la guanine (Architectural and mechanistic insights into an EHD ATPase involved in membrane remodelling 2007).
2. Les protéines doivent être activées (
a. Dans les dimères, les domaines EH se lient à un motif interne Gly-Pro-Phe (GPF) dans le lien situé entre le domaine hélicoïdal et le domaine EH, i.e. les EHD se retrouvent en conformation inhibée.
b. Lors de la liaison à la membrane, on assiste à une série de changements conformationnels (
- Les domaines EH sont déplacés de leur site auto-inhibiteur sur le domaine GTPase, ce qui permet leur libération pour la liaison avec des partenaires contenant un motif NPF (asparagine-proline-phénylalanine), comme ceux de MICAL-L1 et des syndapines/PACSINes.
- La boucle KPF crée une nouvelle interface d'assemblage avec le domaine hélicoïdal du dimère EHD adjacent, stabilisant ainsi la conformation active et favorisant l'oligomérisation des EHD au niveau de la membrane.
- On assiste à la tubulation membranaire.
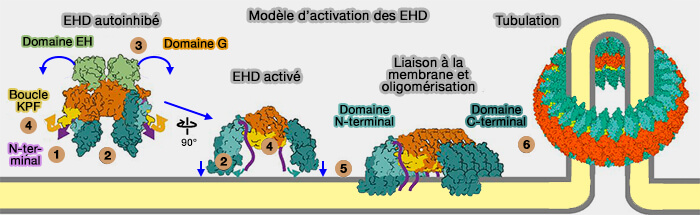
(Figure : vetopsy.fr d'après Melo et coll)
MICAL-L1
Vue d'ensemble
La tubulation du système de recyclage par Rab8a serait responsable du recyclage des cargos incorporés par les endocytoses indépendantes de la clathrine (CIE), comme pour le CMH (Complexe Majeur d'Histocompatibilité) de classe I (Diacylglycerol Kinase α Regulates Tubular Recycling Endosome Biogenesis and Major Histocompatibility Complex Class I Recycling 2014 et MICAL-L1 is a tubular endosomal membrane hub that connects Rab35 and Arf6 with Rab8a 2012).
1. MICAL-L1 (Molecule interacting with CasL-like1) est un effecteur de plusieurs petites GTPases Rab, i.e. Rab8, mais aussi Rab10, Rab13 et Rab35, et régulerait cette voie de recyclage (MICAL-L1 is required for cargo protein delivery to the cell surface 2021).

(Figure : vetopsy.fr d'après Giridharan et coll)
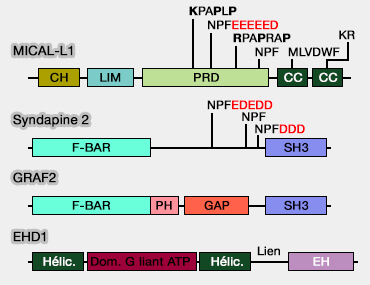
2. La structure de MICAL-L1 comprend :
- un domaine CH (Calponine-Homology),
- un domaine LIM,
- un domaine riche en proline (PRD), avec plusieurs motifs NPF dont un qui se lie avec EHD1 lié lui-même avec l'endosome de recyclage,
- un premier domaine CC (coiled-coil ou superhélice),
- un domaine CC N-terminal qui est un domaine de liaison à Rab/GTP (RBD).
Remarque : contrairement aux autres protéines MICAL (MICAL-Family Proteins: Complex Regulators of the Actin Cytoskeleton 2014), MICAL-L1 et L2 ne contiennent pas le domaine FAD (Flavoprotein Monooxygenase Domain) impliqué dans l'oxydation et le désassemblage de la F-actine (SelR/MsrB Reverses Mical-mediated Oxidation of Actin to Regulate F-actin Dynamics 2013).
3. MICAL-L1, associé aux endosomes de recyclage tubulaires de l'ERC (Endocytic Recycling Compartment), est impliqué :
- dans le trafic de récepteurs à la fois des endosomes précoces vers le compartiment de recyclage endocytaire périnucléaire (ERC) et de l'ERC vers la membrane plasmique (The endocytic recycling compartment maintains cargo segregation acquired upon exit from the sorting endosome 2015),
-
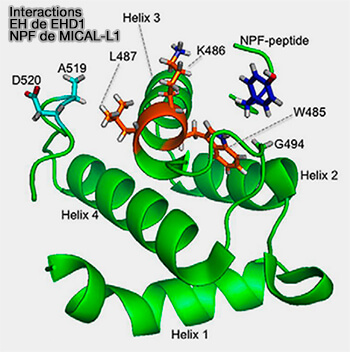
Interactions EH de EHD1 et NPF de MICAL-L1
(Figure : vetopsy.fr d'après Bahl et coll)

Cependant, la composition, la structure et les mécanismes de biogenèse de ces compartiments membranaires ne sont que partiellement connus.
Mécanisme d'action
La biogenèse des endosomes de recyclage implique le recrutement de MICAL-L1, effecteur de plusieurs Rab, et de la syndapine 2 dans des membranes à concentration locale élevée d'acide phosphatidique ou PA (Cooperation of MICAL-L1, syndapin2, and phosphatidic acid in tubular recycling endosome biogenesis 2013).
1. Les diacylglycérol kinases (DGK ou DAGK), EC 2.7.1.107, sont impliquées dans l'internalisation dépendante de la clathrine, mais le CMH I ne contient pas les motifs reconnus pour cette endocytose.
- Toutefois, l'inactivation de DGKα provoque une accumulation de CMH I intracellulaire et en surface, résultat d'une dégradation réduite.
- DGKα est nécessaire à la génération d'acide phosphatidique, composant lipidique essentiel qui sert de point d'ancrage pour MICAL-L1 et la syndapine 2 pour la tubulation des endosomes de recyclage.
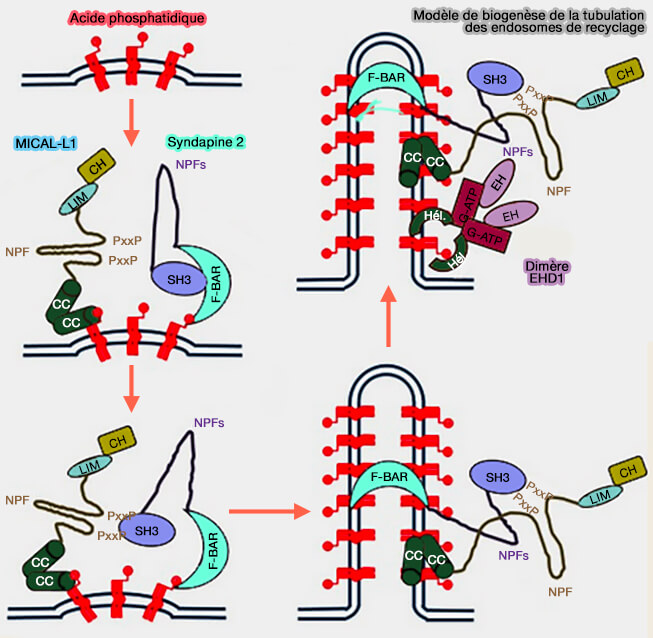
(Figure : vetopsy.fr d'après Giridharan et coll)
2. MICAL-L1 et la protéine de tubulation membranaire syndapine 2, appartenant aux syndapines ou PACSINEs contenant un domaine F-BAR, s'associent sélectivement à l'acide phosphatidique, i.e. DGKα génère de l'acide phosphatidique (PA) pour se localiser au niveau des tubules des endosomes de recyclage.
MICAL-L1 et la syndapine 2 interagissent entre eux via le domaine SH3 de la syndapine 2 et le domaine riche en proline (PRD) de MICAL-L1.

L'interaction MICAL-L1-syndapine 2 conduit à la flexion et à la tubulation de la membrane.
3. MICAL-L1 recrute à la fois Arf6 et EHD1 pour recycler les membranes et favorise la tubulation (MICAL-L1 Links EHD1 to Tubular Recycling Endosomes and Regulates Receptor Recycling 2009 et Differential Roles of C-terminal Eps15 Homology Domain Proteins as Vesiculators and Tubulators of Recycling Endosomes 2013).
MICAL-L1 interagit aussi avec CRMP2 (Collapsin Response Mediator Protein-2 ou DPYSL2) qui contacte les dimères de tubuline (Collapsin Response Mediator Protein-2 (Crmp2) Regulates Trafficking by Linking Endocytic Regulatory Proteins to Dynein Motors 2010).
- La déplétion de CRMP2/MICAL-L1/EHD1 provoque des mouvements rapides des vésicules périphériques contenant par exemple la transferrine intériorisée vers l'ERC (Endocytic Recycling Compartment) le long des microtubules intacts.
- CRMP2, régulateur négatif de la dynéine, module ainsi la motilité inculquée par la dynéine, ralentissant ainsi le mouvement des endosomes en route vers l'ERC (CRMP-2 directly binds to cytoplasmic dynein and interferes with its activity 2009).
- La surexpression de p50, appelé aussi dynamitine, sous-unité de l'épaule de la dynactine, conserve les récepteurs à la périphérie cellulaire, i.e. la dynéine serait la protéine motrice liée au transport vésiculaire basé sur MICAL-L1/EHD1 (Collapsin Response Mediator Protein-2 (Crmp2) Regulates Trafficking by Linking Endocytic Regulatory Proteins to Dynein Motors 2010).
Remarque : la phosphorylation de CRMP2, due à plusieurs kinases dont les ROCK, provoque la rétractation des neurites et détruit les cônes de croissance (
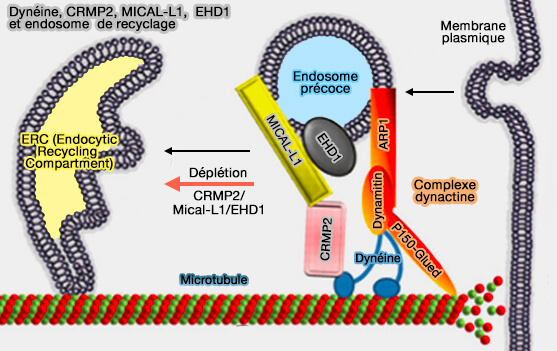
(Figure : vetopsy.fr d'après Rahajeng et coll)
4. EHD3 est ensuite recruté sur ces membranes par l'interaction de son domaine EH avec les motifs NPF de MICAL-L1 et/ou de la syndapine 2 pour stabiliser les structures membranaires nouvellement formées.
- L'épuisement de EHD3 dans les cellules HeLa entraîne une augmentation de la taille des endosomes précoces périphériques et les récepteurs de la transferrine (TfR) ne peuvent atteindre l'ERC (Endocytic Recycling Compartment), mais sont recyclés plus vite par la voie rapide, dépendante des endosomes précoces.
- L'épuisement de EHD4, paralogue de EHD3, a un effet similaire sur les endosomes précoces, mais il peut également réguler le trafic vers les endosomes tardifs plutôt que vers l'ERC (A Role for EHD4 in the Regulation of Early Endosomal Transport 2008).
Il se pourrait que EHD1 rejoigne ensuite ce complexe sur les endosomes de recyclage, où il se lie à la fois à MICAL-L1 et à la syndapine 2, remplaçant éventuellement EHD3 au sein de ce complexe pour effectuer la fission et donner naissance à des vésicules nouvellement formées (Differential Roles of C-terminal Eps15 Homology Domain Proteins as Vesiculators and Tubulators of Recycling Endosomes 2013).
(Figure : vetopsy.fr d'après Kobayashi et coll)
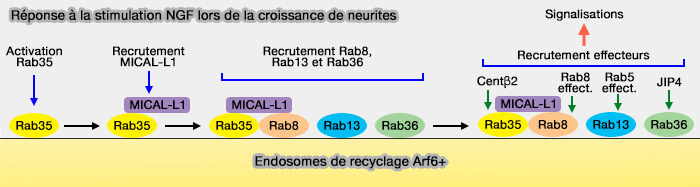
5. Rab35 interagit avec MICAL-L1 et détermine sa localisation au niveau endosomal (Rab35 promotes the recruitment of Rab8, Rab13 and Rab36 to recycling endosomes through MICAL-L1 during neurite outgrowth 2014).
Après cette interaction avec Rab5, et seulement après, MICAL-L1 fonctionne comme une protéine d'échafaudage pour Rab8, Rab13 et Rab36 dans les endosomes de recyclage Arf6 comme par exemple pour la croissance des neurites.
- Rab36 recrute JIP4, une protéine d'échafaudage de la kinésine, pour recycler les endosomes après les interactions dépendantes de Rab35 et dépendant de MICAL-L1. JIP4 interagit aussi avec la dynéine.
- La croissance des neurites est aussi associée aux MCS du réticulum endoplasmique (Repeated ER–endosome contacts promote endosome translocation and neurite outgrowth 2015).
Remarque 1 : la croissance des neurites dans les cellules PC12 fait intervenir d'autres Rab dans différentes populations d'endosomes de recyclage, i.e. Rab8 pour un type, Rab10 et Rab11 pour un autre (Rabin8 regulates neurite outgrowth in both GEF activity–dependent and –independent manners 2016).
Remarque 2 : Rab35, impliqué dans l'endocytose clathrine dépendante (CME), recrute ACAP2, une GAP de Arf6 sur les endosomes précoces pour inactiver Arf6 afin de permettre un tri approprié des cargos A pour les éloigner des cargos B (
Remarque 3 : l'exocytose lysosomale joue également un rôle dans la croissance des neurites, qui nécessite une exocytose d'endosomes tardifs/lysosomes pour l'allongement lors du développement neuronal (
Autres voies ?
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


