Système endo-lysosomal
Nexines du rétromère (3)
SNX27 : reconnaissance des cargos
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Vue d'ensemble des endosomes précoces
- Devenirs des endosomes précoces
- Composants des endosomes précoces
- Rab5 et ses régulateurs
- Rab5 et ses effecteurs
- Complexes d'attache des endosomes précoces : complexe CORVET
- Complexe de tri et de recyclage des endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

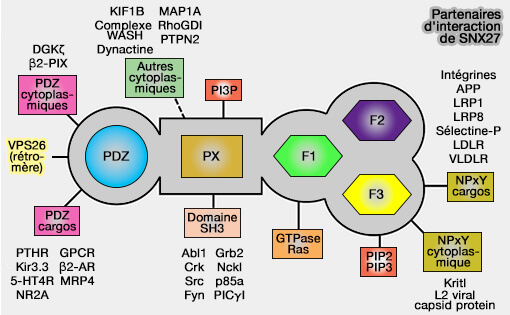
SNX27 interagit avec de nombreux cargos par son domaine PDZ et son domaine FERM, en vue de leur recyclage vers la membrane plasmique via le réseau de microtubules.
SNX27 et reconnaissance des cargos
SNX27 interagit avec de nombreux cargos par :
- son domaine PDZ,
- son domaine FERM.
Domaine PDZ
SNX27 interagit avec la queue cytosolique de nombreux cargos via son domaine PDZ (A unique PDZ domain and arrestin-like fold interaction reveals mechanistic details of endocytic recycling by SNX27-retromer 2014) :
- soit à des protéines avec des motifs de liaison PDZ classiques,
- soit avec des acides aminés phosphorylés.

Le domaine PDZ est étudié dans un chapitre spécial.
(Figure : vetopsy.fr d'après Chandra et coll)
Motifs de liaison PDZ
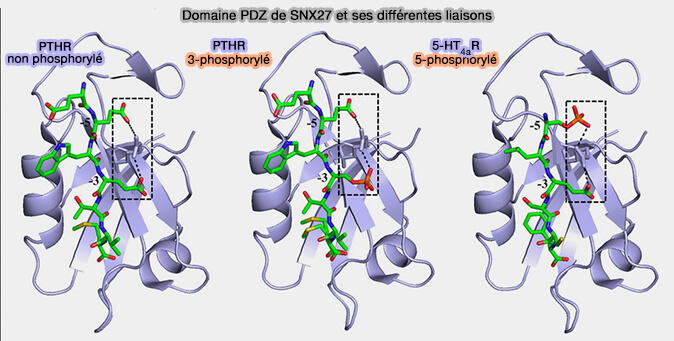
Le domaine PDZ se lie à la fois à des protéines transmembranaires et cytosoliques à l'aide de motifs de liaison PDZ (PDZbm ou PDZ binding motif) de type I classiques par le motif X-S/T–X–Φ, où Φ représente tout résidu hydrophobe (Structural basis for endosomal trafficking of diverse transmembrane cargos by PX-FERM proteins 2013).
1. Les séquences se trouvent souvent dans l'extrémité C-terminale de la protéine et possèdent des chaînes latérales acides aux positions -3 et -5 qui forment une " pince électrostatique " avec une arginine conservée sur la surface SNX27 et améliorent ainsi l'affinité.
(Figure : vetopsy.fr d'après Stangl et coll)
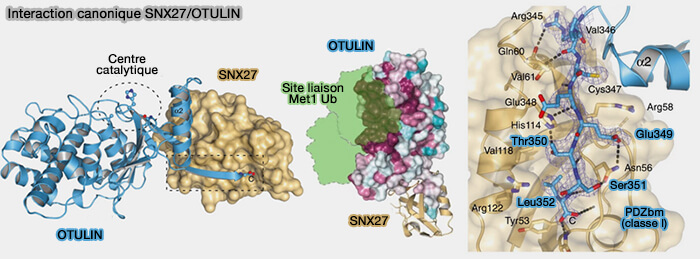
2. Par exemple, le domaine PDZ de SNX27 interagit avec OTULIN, par deux surfaces distinctes et entre en concurrence non catalytique pour la liaison du cargo avec le rétromère.
OTULIN est une enzyme désubiquitinante (DUB) qui hydrolyse spécifiquement les chaînes d'ubiquitine liées à Met1 (Regulation of the endosomal SNX27-retromer by OTULIN 2019).
(Figure : vetopsy.fr d'après Stangl et coll)
a. Pour la première interface, OTULIN contient un PDZbm de classe I conservé (ETSL : Glu349-Thr350-Ser351-Leu352) essentiel pour la liaison de SNX27.
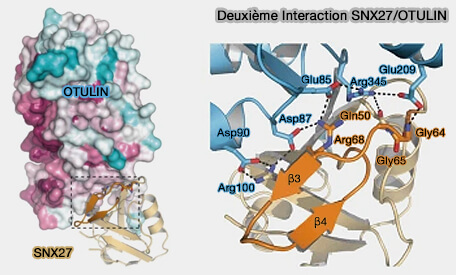
b. Pour la seconde interface, une partie du domaine catalytique OTULIN, i.e. résidus 67-79 contenant une boucle en épingle à cheveux β3-β4 exposée située à proximité immédiate du domaine PDZ, engage aussi VPS26A.
- OTULIN et VPS26A utilisent un site de liaison qui se chevauche partiellement situé dans la boucle en épingle à cheveux β3–β4 de SNX27, i.e. ne peuvent se lier ensemble.
- L'affinité du domaine catalytique d'OTULIN pour le PDZ est multipliée par 30.

L'existence d'autres interfaces secondaires pourrait moduler l'affinité, et donc la sélectivité, des interacteurs du domaine PDZ de SNX27.
Sites de phosphorylation
Le domaine PDZ peut également se lier à des protéines qui ne possèdent pas ces résidus acides, mais qui possèdent à la place des sites de phosphorylation conservés sur les résidus sérine et thréonine qui miment cette pince.
(Figure : vetopsy.fr d'après Chandra et coll)
Récepteurs interagissant avec le domaine PDZ de SNX27

Des centaines de récepteurs de cargos interagissant avec le domaine PDZ de la protéine SNX27 ont été identifiés (A molecular code for endosomal recycling of phosphorylated cargos by the SNX27–retromer complex 2017).
On peut citer par exemple :
- le récepteur adrénergiques β2 couplé à la protéine G (SNX27 mediates PDZ-directed sorting from endosomes to the plasma membrane 2010 et SNX27 mediates retromer tubule entry and endosome-to-plasma membrane trafficking of signaling receptors 2011),
- les récepteurs NMDA au glutamate (A role for sorting nexin 27 in AMPA receptor trafficking 2014 ),
- le récepteur de l'hormone parathyroïdienne (PTHR) (Sorting nexin 27 couples PTHR trafficking to retromer for signal regulation in osteoblasts during bone growth 2016),
- des transporteurs de nutriments (A global analysis of SNX27-retromer assembly and cargo specificity reveals a function in glucose and metal ion transport 2013).
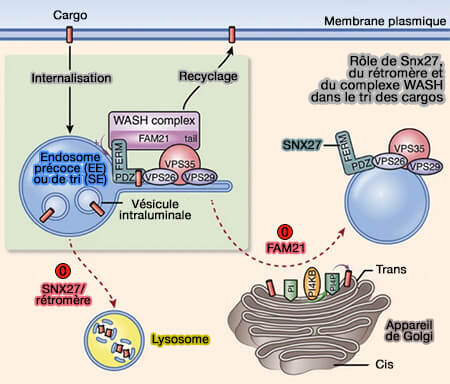
dans le tri des cargos
(Figure : vetopsy.fr d'après Lee et coll)
Domaine FERM
SNX27 interagit aussi avec de nombreux cargos au motif NPxY, par son domaine FERM.
Par exemple, c'est le cas des intégrines ou des récepteurs aux lipoprotéines.
Caractéristique de SNX27
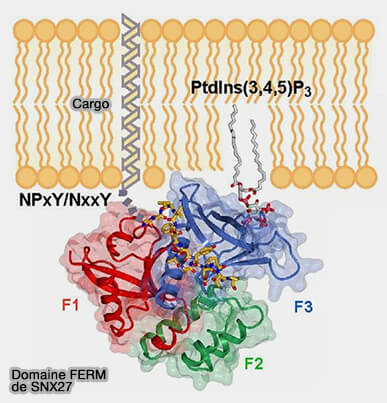
1. Le domaine FERM comprend trois sous-domaines appelés F1, F2 et F3.

Le domaine FERM est étudié dans un chapitre spécial.
2. L'homologie séquentielle du domaine FERM de SNX27 est faible par rapport au domaine FERM canonique de SNX17 et de SNX31.
F2 est beaucoup plus petit (Phox homology band 4.1/ezrin/radixin/moesin-like proteins function as molecular scaffolds that interact with cargo receptors and Ras GTPases 2011).
Protéines interagissant avec le domaine FERM de SNX27
1. F1 se lie aux petites GTPases RAS (PX-FERM proteins A link between endosomal trafficking and signaling ? 2011 et Phox homology band 4.1/ezrin/radixin/moesin-like proteins function as molecular scaffolds that interact with cargo receptors and Ras GTPases 2011).
- Ras est associé à de multiples voies de signalisation impliquées dans la signalisation oncogène (The spatiotemporal regulation of RAS signalling 2016).
- F1 serait également impliqué dans la liaison des protéines cargo NPxY.
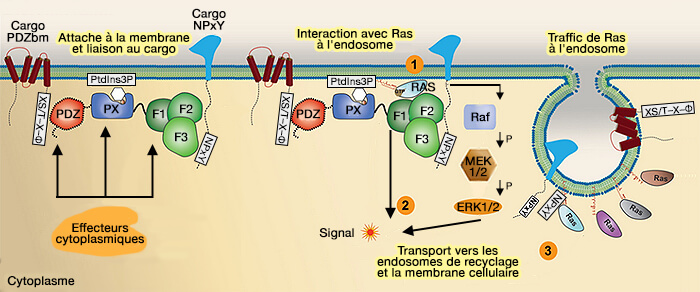
(Figure : vetopsy.fr d'après Ghai et coll)
D'autres protéines du domaine FERM pourraient posséder une activité de liaison similaire.
- Krit1 a été identifié comme effecteur pour Rap1, une autre protéine de la famille Ras. Krit1 interagit avec Rap1 via son domaine FERM et stabilise les jonctions épithéliales (Structural and functional differences between KRIT1A and KRIT1B isoforms: A framework for understanding CCM pathogenesis 2009).
- Les canaux potassiques GIRK (G-protein regulated Inward Rectifying potassium ou K), une sous-famille des canaux Kir, régulent l'excitabilité neuronale et dépendent également du domaine FERM de SNX27 pour leur localisation, i.e. tri des cargo et leur trafic (Ras-Association Domain of Sorting Nexin 27 Is Critical for Regulating Expression of GIRK Potassium Channels 2013).
(Figure : vetopsy.fr d'après Ghai et coll)
2. F3 se lie :
- aux récepteurs cargo en utilisant de courts motifs NPxY présents dans les queues cytosoliques des récepteurs de signalisation activés,
- aux phosphoinositides chargés négativement.
F3 possède un site de liaison pour des groupes de tête de phosphoinositides spécifiques, PI(3,4,5)P3 ou PIP3 plus abondants au niveau de la membrane plasmique, et PI(3)P dans les endosomes tardifs (Phosphoinositide binding by the SNX27 FERM domain regulates its localization at the immune synapse of activated T-cells 2015).
- La perturbation de l'interaction FERM/PI(3)P réduit l'association de SNX27 avec les endosomes de recyclage.
- Cela suggère un mécanisme potentiel de redistribution dépendante de l'activation de SNX27 vers la membrane plasmique.
SNX27 et recyclage du
cargo vers la membrane
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


