Système endo-lysosomal
Endosomes précoces
Complexes de tri ou de recyclage :
rétromère
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Vue d'ensemble des endosomes précoces
- Devenirs des endosomes précoces
- Composants des endosomes précoces
- Rab5 et ses régulateurs
- Rab5 et ses effecteurs
- Complexes d'attache des endosomes précoces : complexe CORVET
- Complexe de tri et de recyclage des endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

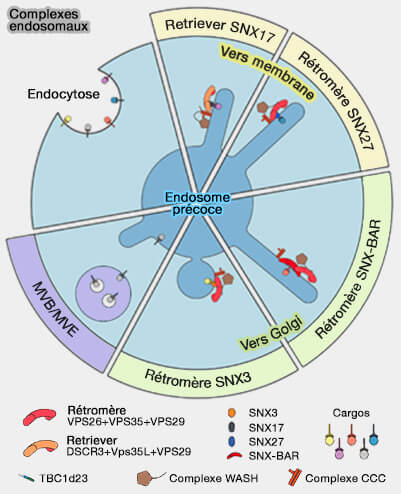
Le rétromère est un complexe de protéines hautement conservé par l'évolution qui joue un rôle important dans le tri et le trafic des endosomes précoces (Quick guide : retromer 2017).
(Figure : vetopsy.fr d'après Wang et all)
Le rétromère trie les protéines transmembranaires comme les récepteurs de signalisation, les canaux ioniques, les transporteurs ou les enzymes, pour leur éviter la dégradation lysosomale.
Dans les endosomes précoces, on trouve d'autres complexes qui permettent le tri ou le recyclage des cargos, comme :
- le complexe retriever et le complexe CCC,
- les complexes CHEVI et FERARI,
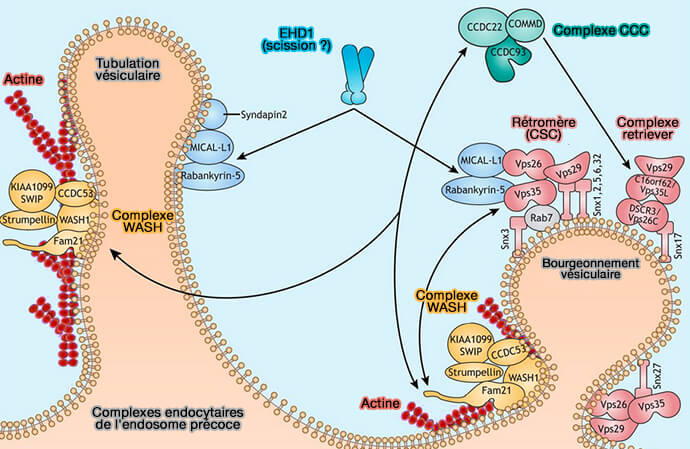
- le complexe WASH qui active le complexe Arp2/3 pour induire la polymérisation de l'actine sur les endosomes, en liaison avec les complexes précédents.
Vue d'ensemble
1. Le rétromère a été considéré :
- tout d'abord comme un complexe qui renvoie des récepteurs des endosomes vers le trans-Golgi, comme le récepteur du CI-MPR (Cation-Independent-Mannose 6-Phosphate Receptor), ce qui est contesté aujourd'hui (
ESCPE-1 et CI-MPR),
- avant de savoir qu'il joue également un rôle essentiel dans le transport membranaire endosome-plasma (Endosomal receptor trafficking: Retromer and beyond 2018).

Chez les métazoaires, le complexe rétromère est considéré comme un " maître régulateur " du tri des protéines au niveau des membranes endosomales (Retromer: a master conductor of endosome sorting 2014).
2. Le rétromère trie les protéines transmembranaires pour leur éviter la dégradation lysosomale et les envoie :
- à la membrane plasmique,
- au réseau trans-Golgi (TGN),
- à des endosomes de recyclage. (Cargo-selective endosomal sorting for retrieval to the Golgi requires retromer 2004)
(Figure : vetopsy.fr d'après Naslavsky et coll)
3. Selon les auteurs, le rétromère mammalien est un complexe formé :
- soit par un hétérotrimère seul, CSC (Cargo Selection Complex) ou core trimer ou rétromère au sens strict, cas le plus fréquent et qui sera utilisé dans vetopsy.fr.
- soit par un complexe plus large incluant les nexines.
Structure de l'hétérotrimère CSC
Le trimère de tri des protéines vacuolaire (VPS ou Vacuolar Protein Sorting) contient VPS35, VPS26A/VPS26B et VPS229, i.e. équivalents de Vps35, Vps26 et Vps29 de la levure (Assembly and Solution Structure of the Core Retromer Protein Complex 2010).
VPS35
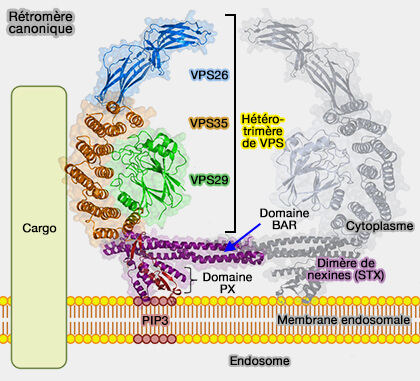
(Figure : vetopsy.fr d'après Kianzoidlee)
1. VPS35, une protéine de 796 résidus, contient un domaine solénoïde formé par 34 hélices α (α1–34).
Pour la constitution du rétromère, VPS35 va former un hétérotrimère avec VPS26 et VPS29.
2. Toutefois, VPS35 peut se lier uniquement soit avec VPS26, soit avec VPS29, créant des hétérodimères (Retromer: Structure, function, and roles in mammalian disease 2015).
3. VPS35 interagit :
- avec le domaine PX de SNX3 du rétromère/SNX3 (
Liaison de VPS26 à SNX3),
- avec le complexe WASH, via sa sous-unité Fam21 par son domaine FERM,
- avec ANKRD50 (ANKyrin-Repeat-Domain-containing protein 50).
Remarque : une mutation de Vps35 provoque une maladie de Parkinson héréditaire d'apparition tardive.
VPS26
1. VPS26 possède un pli arrestine près de l'extrémité du domaine C-terminal qui se lie avec l'extrémité N-terminale de VPS35 sur un motif PRL/MYL (Identification of a conserved motif required for Vps35/Vps26p interaction and assembly of the retromer complex 2008).
2. La boucle flexible, β15 et β16 qui comprend des résidus hydrophobes et une glycine conservée phylogénétiquement, fournit un mécanisme d'intégration de Vps26 dans le rétromère (Structure of Vps26B and Mapping of its Interaction with the Retromer Protein Complex 2007).
Elle laisse le reste de la structure libre pour les engagements avec les membranes et pour les changements de conformation (The retromer subunit Vps26 has an arrestin fold and binds Vps35 through its C-terminal domain 2006).
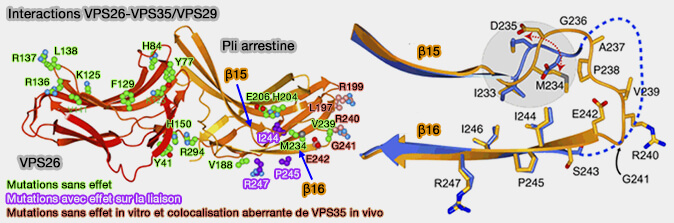
(Figure : vetopsy.fr d'après Collins et coll)
3. VPS26 interagit :
- avec le domaine PDZ de SNX27 du rétromère/SNX27 (
Liaison de VPS26 à SNX27),
- avec le domaine PX de SNX3 du rétromère/SNX3 (
Liaison de VPS26 à SNX3).
VPS29
VPS29 possède un pli métallophosphoestérase qui se lie au pli α-solénoïde C-terminal (résidus 307-796) de VPS35 (Vps29 has a phosphoesterase fold that acts as a protein interaction scaffold for retromer assembly 2005 et Functional architecture of the retromer cargo-recognition complex 2007 et The human Vps29 retromer component is a metallo-phosphoesterase for a cation-independent mannose 6-phosphate receptor substrate peptide 2006).
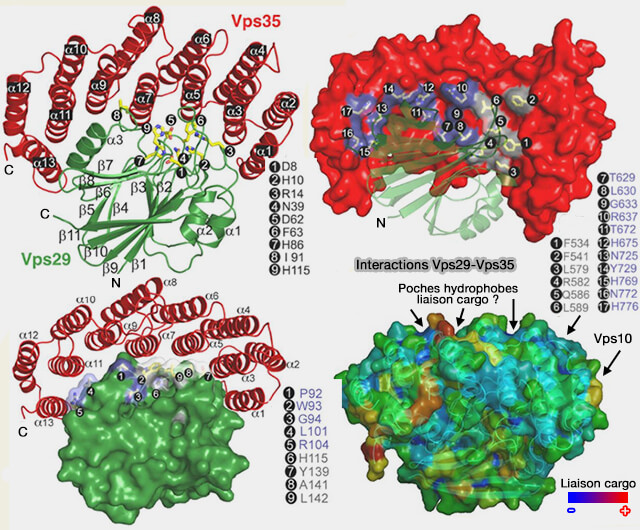
(Figure : vetopsy.fr d'après Hierro et coll)
Recrutement du CSC : interactions du rétromère
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


