Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
4-5 : rôles des myosines
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Dans l'endocytose clathrine-dépendante (CME), les myosines, dont la myosine VI, fournissent la force mécanique pour s'opposer à la tension membranaire et favorisent l'étape de fission finale dépendante de la dynamine.
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
Les myosines joueraient un rôle dans les stades :
Ces interactions avec la myosine sont en cours d'étude (Nonmuscle Myosin II Is a Critical Regulator of Clathrin-Mediated Endocytosis 2014).
Myosine VI
La myosine VI est le seul moteur à fonctionner à contre-sens, i.e. vers l'extrémité (-) [Clathrin light chain A drives selective myosin VI recruitment to clathrin-coated pits under membrane tension 2019].
Liaisons de la myosine VI
Liaison à la clathrine
La myosine VILONG possède une hélice α2 qui contient un domaine de liaison à la chaîne légère (CLCa) de la clathrine (Diverse functions of myosin VI elucidated by an isoform-specific α-helix domain 2016).
Elle interagit via (Diverse functions of myosin VI elucidated by an isoform-specific α-helix domain 2016) :
- une poche hydrophobe formée par A51 et I54,
- une liaison hydrogène entre D56 et Y1091,
- l'insertion de L55 entre les hélices α2 et α4 de la myosine VI.
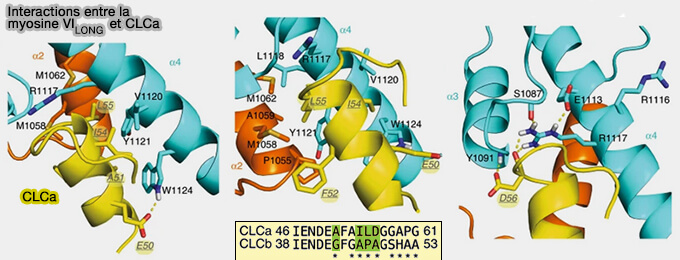
(Figure : vetopsy.fr d'après Biancospino et coll)
Autres liaisons
Le domaine C-terminal de la queue de cette myosine contient 3 sites de liaison (Myosin VI targeting to clathrin-coated structures and dimerisation is mediated by binding to Disabled-2 and PtdIns(4,5)P2 2009).

(Figure : vetopsy.fr d'après Magistrati et coll)
1. Le motif WWY est impliqué dans l'interaction avec Dab2 (adaptateur alternatif), qui stabiliserait la dimérisation de la myosine VI pour permettre un mouvement processif sur les filaments d'actine (Myosin VI Undergoes Cargo-Mediated Dimerization 2009).
2. Le motif RRL interagit avec deux protéines.
a. La GIPC (GAIP-interacting protein, C terminus) intervient sur :
- les vésicules d'endocytose recouvertes ou non (RGS-GAIP, a GTPase-activating Protein for Gαi Heterotrimeric G Proteins, Is Located on Clathrin-coated Vesicles 1998),
- les endosomes initiaux par le domaine PDZ de APPL1 (The PDZ Protein GIPC Regulates Trafficking of the LPA1 Receptor from APPL Signaling Endosomes and Attenuates the Cell’s Response to LPA 2012).

(Figure : vetopsy.fr d'après Magistrati et coll)
b. L'optineurine, protéine associée à l'appareil de Golgi et à la sécrétion, est une protéine adaptatrice recrutée également au cou des tubules et qui délimite la zone de scission (
L'optineurine interagit aussi avec Rab8, l'huntingtine, le récepteur de la transferrine (TfR) et la TANK-binding kinase 1 (Cellular et molecular biology of optineurine 2012).
Remarque : le motif RRL se lie aux chaînes d'ubiquitine et aux adaptateurs de l'autophagie (
3. Un site se lie spécifiquement avec une haute affinité à des liposomes contenant PI(4,5)P2, qui provoque une dimérisation de la queue lorsqu'elle est associée à des gouttelettes lipidiques.

L'action coordonnée de la myosine VI et de la chaîne légère CLCa de la clathrine, et non CLCb, à la surface apicale contribuerait à la séparation des puits recouverts de clathrine.
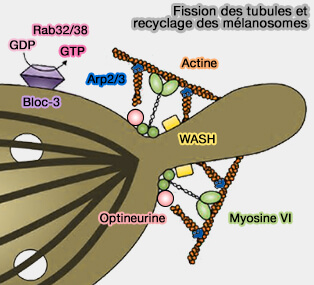
des mélanosomes
(Figure : vetopsy.fr d'après Ripoll et coll)
Remarque : la myosine VI et Hip1R (Hip1-related Protein) interagissent exclusivement avec CLCa, mais s'excluent mutuellement (
Modèle hypothétique
Le modèle hypothétique de séparation des puits recouverts de clathrine (CCP) dans un tissu polarisé, i.e. où la tension membranaire est supérieure à la normale et la dynamique de l'actine est critique pour l'invagination et la fission membranaires, pourrait être le suivant (Clathrin light chain A drives selective myosin VI recruitment to clathrin-coated pits under membrane tension 2019).
1. Au fur et à mesure que le puits se développe, la myosine VI est recrutée dans les CCP par la chaîne légère CLCa de la clathrine et désengage Hip1R (Hip1-related Protein), qui s'associe préférentiellement à l'epsine au bord du CCP.
- L'ancrage et la polymérisation de l'actine sont ainsi limités au col du puits qui s'invagine à l'endroit où Hip1R ainsi que l'epsine fournissent un lien entre la nucléation de l'actine et le CCP.
- La formation d'un complexe entre les epsines et Hip1R au niveau du cou recruterait l'Hip1R du manteau, i.e. Hip1R qui est attaché aussi à CLCa, exposant le site de liaison de la myosine VI, ce qui a comme conséquence de recruter la myosine VI.
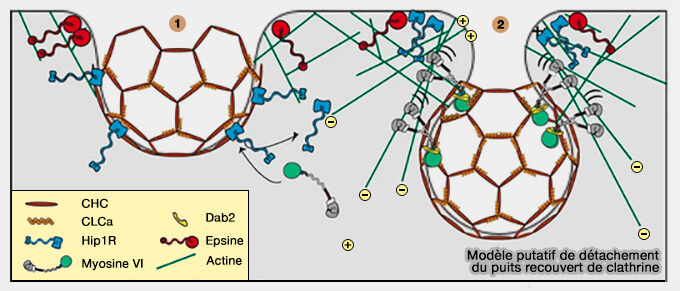
(Figure : vetopsy.fr d'après Biancospino et coll)
2. Le monomère de myosine lié à CLCa ancre le CCP au maillage d'actine engagé dans le flux rétrograde et facilite le mouvement de la vésicule dans le cytoplasme.
Après la dimérisation induite par Dab2 ou l'oligomérisation, la myosine VI devient un moteur processif qui marche vers l'extrémité négative des microfilaments d'actine.

La myosine VI fournit alors la force mécanique pour s'opposer à la tension membranaire dans les tissus polarisés et favorise l'étape de fission finale médiée par la dynamine.
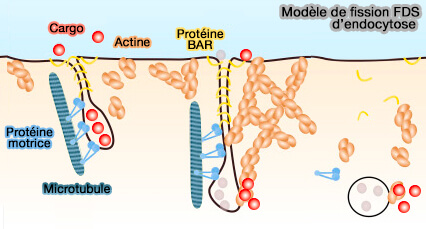
(Figure : vetopsy.fr d'après Simunovic et coll)
Remarques : la myosine VI interviendrait dans un mécanisme de fission membranaire appelé friction-driven scission (FDS), lié aux microtubules et aux protéines à domaine BAR, comme l'endophilline qui courbe la membrane par son domaine ENTH (
La myosine VI a aussi un rôle un rôle dans le transport des cargos dans les endosomes initiaux et dans la fission des mélanosomes (
Autres myosines
Les myosines, autres que la mysosine VI, interviendraient plutôt dans l'endocytose clathrine-indépendante (CIE ou Clathrin Indépendant Endocytosis), mais les scientifiques ne sont pas d'accord entre eux.
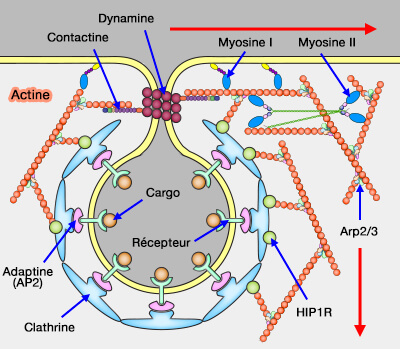
(Figure : vetopsy.fr)
1. La myosine I (en particulier la myosine IE à longue queue) peut ancrer l'actine à la membrane plasmique (Myosin 1E coordinates actin assembly and cargo trafficking during clathrin-mediated endocytosis 2011).
Par son domaine SH3, elle peut interagir avec :
- les NPF (Nucleation Promoting Factor) par leur domaine PRD, qui activent le complexe Arp2/3 pour polymériser l'actine,
- la dynamine et la synaptojanine.
2. Les myosines II favoriseraient l'invagination de la membrane et le mécanisme de détachement (Nonmuscle Myosin II Is a Critical Regulator of Clathrin-Mediated Endocytosis 2014 et Myosin II isoforms promote internalization of spatially distinct clathrin-independent endocytosis cargoes through modulation of cortical tension downstream of ROCK2 2021).
6. Migration de la vésicule vers l'intérieur de la cellule
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


