Fusion vésiculaire : chaperons des protéines SNARE
Protéines SM (Sec1/Munc18)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

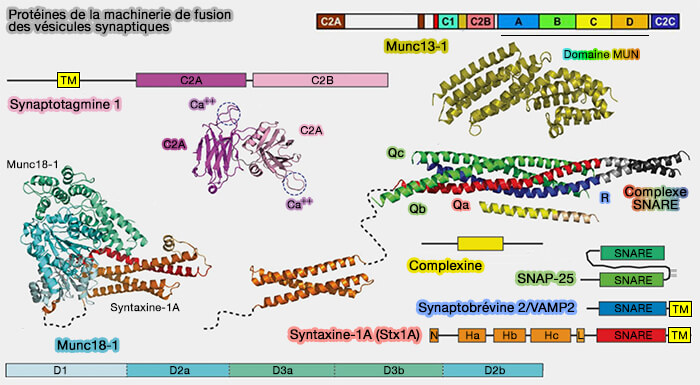
Les protéines SNARE et les protéines SM (Sec1/Munc18) constituent le moteur moléculaire central qui pilote presque toute la fusion et l'exocytose des membranes intracellulaires.
Sec1 (SECretory-1) est retrouvé chez la levure et Munc18 (Mammalian uncoordinated-18) est l'homologue de UNC-18 (UNCoordinated-18) de Caenorhabditis elegans, d'où le nom SM pour ces protéines.

Ce chapitre est largement inspiré par : Chaperoning SNARE Folding and Assembly (2021), qui fait le point sur les interactions encore obscures entre SNARE et SM.
Vue d'ensemble des protéines SM (Sec1/Munc18)
Les voies physiologiques de l'assemblage des SNARE et le rôle joué par les protéines SM ne sont pas encore entièrement dévoilés (Membrane Fusion: Grappling with SNARE and SM Proteins 2009).
(Figure : vetopsy.fr d'après Jahn et Fasshauer)
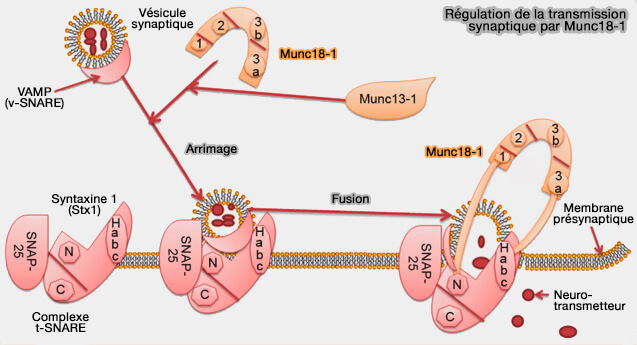
1. Les protéines SM (Sec1/Munc18) ont de multiples sites de liaison pour les protéines SNARE et sont indispensables à l'amarrage des complexes pour la fusion membranaire.
Les SNARE s'assemblent par étapes avec une cinétique caractéristique et les protéines SM chaperonnent l'assemblage SNARE, ce qui permet d'éviter :
- des associations de SNARE qui sont incapables de piloter la fusion membranaire (
absence de chaperons),
- le désassemblage de complexe SNARE partiel en construction par la machinerie NSF/SNAP (
désassemblage du complexe SNARE).
2. Le processus le plus étudié à l'heure actuelle est la fusion des vésicules synaptiques avec la membrane plasmique pour permettre la libération de neurotransmetteurs dans la fente synaptique.
Ce processus déclenché par le calcium nécessite des protéines régulatrices supplémentaires telles que (The pre-synaptic fusion machinery 2019 et Molecular mechanisms of fast neurotransmitter release 2018 et Mechanism of neurotransmitter release coming into focus 2018) :
Classification des SM
Les protéines SM, 7 chez l'homme, sont divisées en quatre familles qui fonctionnent dans différentes voies de trafic.
1. Munc18 (Mammalian uncoordinated-18) comprend, chez l'homme, trois homologues :
- Mun18-1 (ou STXBP1, syntaxin (Stx)-Binding Protein 1) est exprimé fortement dans les neurones et les cellules neuroendocrines.
- Munc18-2 (STXBP2) et Munc18-3 (STXBP3) sont engagés dans la sécrétion des cellules immunitaires.
Mun18-1 :
- régule la transmission des neurotransmetteurs en participant au mécanisme de fusion des vésicules synaptiques en interagissant avec le complexe SNARE (
interactions avec les SNARE),
- participe à la régulation de la plasticité synaptique et du développement neurologique par l'exocytose régulée des neurones et des cellules neuroendocrines (
cf. revue dans Role of Munc18-1 in the biological functions and pathogenesis of neurological disorders 2018).
(Figure : vetopsy.fr d'après van der Beck et coll)
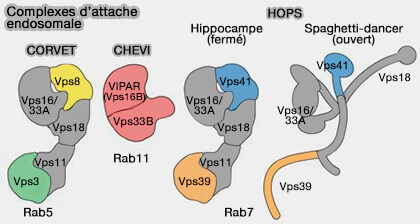
2. VPS33 (VPS33A, VPS33B) est présent dans les complexes d'attache (ou d'amarrage) à multi-sous-unités (MTC) comme les complexes :
- CORVET des endosomes précoces,
- HOPS des endosomes tardifs,
- CHEVI dans plusieurs catégories d'endosomes (
rôles de CHEVI dans le recyclage).
3. Vps45, Tlg2 (Qa-SNARE) et ses SNARE apparentées, et le complexe de liaison GARP de la famille CATCHR fonctionnent tous dans le trafic des endosomes au réseau trans-Golgi (The Sec1/Munc18 protein Vps45 holds the Qa-SNARE Tlg2 in an open conformation 2020).
Remarque : Munc13, protéine essentielle dans l'exocytose neuronale, contient également un domaine CATCHR (Mechanistic insights into neurotransmitter release and presynaptic plasticity from the crystal structure of Munc13-1 C1C2BMUN 2017).
(Figure : vetopsy.fr d'après Baker et coll)
4. Sly1 jouerait un rôle dans le transport rétrograde appareil de Golgi/réticulum endoplasmique (RE) via son interaction avec COG4 (The SM protein Sly1 accelerates assembly of the ER-Golgi SNARE complex 2014 et Multiple SNARE interactions of an SM protein: Sed5p/Sly1p binding is dispensable for transport 2004).
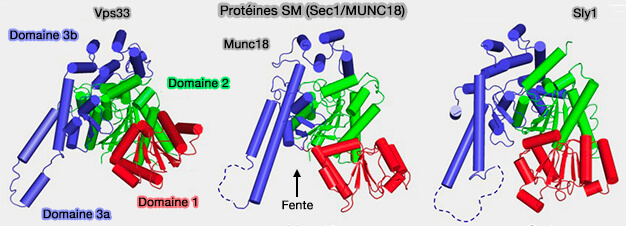
Structure des SM
1. Les structures des SM partagent les mêmes formes globales et topologies, i.e. elles sont en forme d'arche et contiennent trois domaines.
Munc18-1 présente une structure arquée (Munc18-1 induces conformational changes of syntaxin-1 in multiple intermediates for SNARE assembly 2020).
- Les domaines 1, 2, 3a et 3b forment l'arc.
- les domaines 1 et 3a forment une cavité arquée, i.e. le domaine 3a est en contact avec le Habc de la Stx1 et le domaine 1, situé de l'autre côté, se lie au peptide N-terminal.
(Figure : vetopsy.fr d'après Tang et coll)
Pour Vps33 (Crystal Structures of the Sec1/Munc18 (SM) Protein Vps33, Alone and Bound to the Homotypic Fusion and Vacuolar Protein Sorting (HOPS) Subunit Vps16 2013) :
- le domaine 1 correspond aux résidus 1-138,
- le domaine 2 aux résidus 139-248 et 502-667,
- le domaine 3, résidus 249-501 subdivisé en 3a (résidus 249-380) et 3b (résidus 381-501).

La caractéristique la plus notable est la cavité arquée qui permettra de recevoir :
- la Qa-SNARE,
- le complexe t-SNARE.
Interactions SNARE/SM
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


