Système endo-lysosomal
Complexe ESCRT
ESCRT-0 et ESCRT-I
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Le complexe ESCRT est composé de 5 complexes impliqués pendant les évènements de remodelage de la membrane cellulaire, dont ESCRT-0, qui se lie à ESCRT-I, et qui possède 5 motifs d’interaction pour se lier aux cargos ubiquitinés.
Le complexe ESCRT (Endosomal Sorting Complex Required for Transport ou complexe de tri endosomal requis pour le transport) est composé de 5 complexes :
- ESCRT-0,
- ESCRT-I,
- ESCRT-II,
- ESCRT-III,
- Vps4 (Vacuolar Protein Sorting 4) qui contient un domaine catalytique AAA+ ATPase.
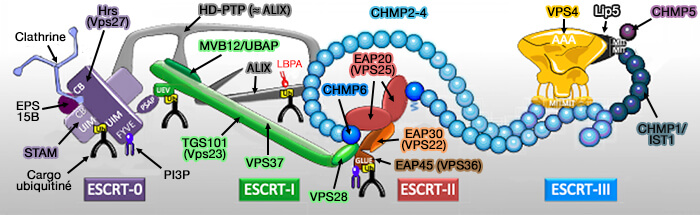
(Figure : vetopsy.fr d'après Christ et Hill)
ESCRT-0 et cargos ubiquitinés
ESCRT-0 possède 5 motifs d’interaction pour se lier aux cargos ubiquitinés.
Vue d'ensemble
1. ESCRT-0 est impliqué dans le trafic vers les endosomes EEA1 positifs (ESCRT-0 marks an APPL1-independent transit route for EGFR between the cell surface and the EEA1-positive early endosome 2015).
APPL1 est localisé dans un sous-ensemble d'endosomes Rab5-positifs, compartiments précurseurs des endosomes précoces que nous avons appelés, dans vetopsy.fr, endosomes initiaux (
2. ESCRT-0 est un hétérotrimère composé par (Hybrid Structural Model of the Complete Human ESCRT-0 Complex 2009) :
- la protéine HRS (Hepatocyte growth factor Receptor tyrosine kinase Substrate),
-
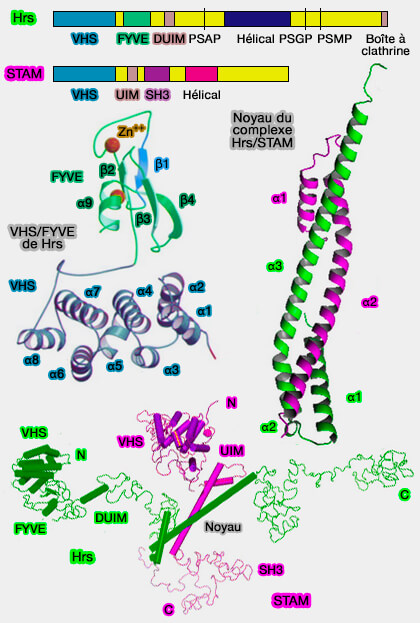
Hrs et STAM
(Figure : vetopsy.fr d'après McCullough et coll) - la protéine STAM (Signal Transducing Adaptor Molecule).
Protéine Hrs/Vps27
1. La protéine Hrs (Hepatocyte growth factor Receptor tyrosine kinase Substrate), homologue de Vps27 de la levure, active et initie le complexe ESCRT en se liant à plusieurs molécules.
1. Hrs se lie au phosphoinositide PI(3)P par son domaine FYVE (FYVE and coiled-coil domains determine the specific localisation of Hrs to early endosomes 2001 et The ESCRT machinery in endosomal sorting of ubiquitylated membrane proteins 2009).
2. Hrs se lie à la clathrine par une boîte à clathrine à son extrémité C-terminale (Concerted ESCRT and clathrin recruitment waves define the timing and morphology of intraluminal vesicle formation 2018).

Le recrutement de la clathrine par Hrs est donc essentiel pour permettre un tri efficace des cargos vers la voie endo-lysosomale.
2. Hrs se lie à :
- EPS15B (An endosomally localized isoform of Eps15 interacts with Hrs to mediate degradation of epidermal growth factor receptor 2008),
- aux cargos ubiquitinés via son domaine DUIM (double face ubiquitin-interacting motif),
- à la sous-unité TSG101/Vps23 de ESCRT-I par son motif PSAP, qui la recrute par son domaine UEV (ubiquitine E2 variant) (Hrs regulates multivesicular body formation via ESCRT recruitment to endosomes 2008).
Remarque : le virus VIH imite Hrs et recrute ESCRT-I pour faciliter son bourgeonnement en mimant le motif PSAP (HIV Gag mimics the Tsg101-recruiting activity of the human Hrs protein 2003).
3. La région C-terminale de Hrs pourrait aussi reconnaître des patchs hydrophobes sur des cargos et les cibler vers la voie endosomale en l’absence totale d’ubiquitine.
Ce serait le cas pour :
- les interleukines (Ubiquitin-independent binding of Hrs mediates endosomal sorting of the interleukin-2 receptor β-chain 2008),
- les cytokines (Hrs Recognizes a Hydrophobic Amino Acid Cluster in Cytokine Receptors during Ubiquitin-independent Endosomal Sorting 2011).
EPS15B
1. EPS15B (Epidermal growth factor receptor ([EGFR] Pathway Substrate 15) se lie (Eps15: a multifunctional adaptor protein regulating intracellular trafficking 2009) :
- aux cargos ubiquitinés par deux motifs UIM, comme ceux des epsines par exemple,
- aux oreilles de l'adaptine (AP-2), composant des cages de clathrine, par de nombreux motifs DPF, i.e. aspartate (D)-Proline (F)-Phénylalanine (F), (The Ear of α-Adaptin Interacts with the COOH-terminal Domain of the Eps15 Protein 1996 et Mapping of Eps15 Domains Involved in Its Targeting to Clathrin-coated Pits 2000),
-
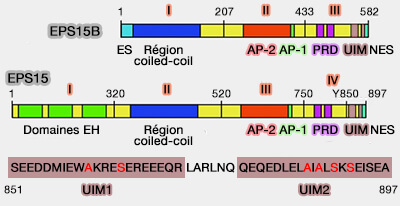
EPS15B et EPS15
(Figure : vetopsy.fr d'après van Bergen et coll)
2. EPS15 est impliqué dans l'endocytose clathrine dépendante (CME).
Protéine STAM
La protéine STAM (Signal-Transducing Adaptor Molecule), qui comprend deux isoformes chez l'homme, i.e. STAM et STAM2, se lie à deux molécules essentielles.
1. STAM se lie à l'ubiquitine via (Evidence for Cooperative and Domain-specific Binding of the Signal Transducing Adaptor Molecule 2 (STAM2) to Lys63-linked Diubiquitin 2012) :
Les protéines contenant des domaines VHS sont toutes impliquées dans le trafic et le tri intracellulaire (STAM Proteins Bind Ubiquitinated Proteins on the Early Endosome via the VHS Domain and Ubiquitin-interacting Motif 2003 et VHS domains of ESCRT-0 cooperate in high-avidity binding to polyubiquitinated cargo 2010),
Le domaine VHS est presque identique au domaine ENTH (Epsin N-Terminal homology) des epsines et au domaine ANTH (AP180/CALM - Clathrin Assembly Lymphoid Myeloid Leukemia -NH2-Terminal Homology) des Hip1.
2. STAM, par son domaine SH3, se lie aux DUB, i.e. enzymes de désubiquitination qui sont colocalisées aux membranes endosomales par leur liaison au domaine terminal de la chaîne lourde de la clathrine (Clathrin anchors deubiquitinating enzymes, AMSH and AMSH-like protein, on early endosomes 2006 et Evidence for Cooperative and Domain-specific Binding of the Signal Transducing Adaptor Molecule 2 (STAM2) to Lys63-linked Diubiquitin 2012).
On trouve, par exemple, deux désubiquitinases, impliquées aussi dans le recyclage du complexe ESCRT :
- AMSH (Associated Molecule with the Src homology 3 domain of STAM), appelée aussi STAMPB (Activation of the Endosome-Associated Ubiquitin Isopeptidase AMSH by STAM, a Component of the Multivesicular Body-Sorting Machinery 2006 et Mechanism of Recruitment and Activation of the Endosome-associated Deubiquitinase AMSH 2013),
- UBPY (Ub-specific protease Y), appelée aussi USP8 (The Ubiquitin Isopeptidase UBPY Regulates Endosomal Ubiquitin Dynamics and Is Essential for Receptor Down-regulation 2006).

Ces interactions concentrent ESCRT-0 dans des microdomaines endosomaux afin de faciliter le tri des cargos.
ESCRT-I
1. ESCRT-I est un hétérotétramère, en forme de " hochet ", composé par plusieurs protéines (Molecular Architecture and Functional Model of the Complete Yeast ESCRT-I Heterotetramer 2007).
a. La tige est formée par :
-
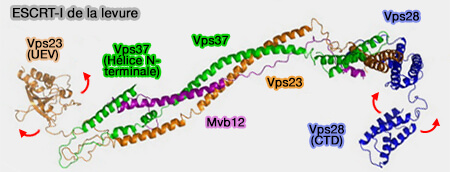
ESCRT-I de la levure
(Figure : vetopsy.fr d'après Kostelansky et coll) - VPS37, i.e. isoformes A, B et C (VPS37 Isoforms Differentially Modulate the Ternary Complex Formation of ALIX, ALG-2, and ESCRT-I 2013),
- MVB12, i.e. isoformes A et B, ou UBAP1 (Efficient Cargo Sorting by ESCRT-I and the Subsequent Release of ESCRT-I from Multivesicular Bodies Requires the Subunit Mvb12 2007et UBAP1 Is a Component of an Endosome-Specific ESCRT-I Complex that Is Essential for MVB Sorting 2011).
b. La tête est constituée par VPS28 (Vacuolar Protein Sorting-associated protein 28).
2. Chaque protéine est présente en un seul exemplaire par complexe (stœchiométrie de 1 : 1 : 1 : 1) pour former ESCRT-I, et la combinaison des différentes isoformes permet l'assemblage de types variés de complexes ESCRT-I spécifiques d’un compartiment (ESCRT-dependent cargo sorting at multivesicular endosomes 2019).
3. La liaison avec ESCRT-0 est réalisée avec le motif PSAP de Hrs par le domaine UEV (Ubiquitin-conjugating Enzyme E2 Variant) de TSG101/Vps23.
4. ESCRT-I peut aussi se lier aux cargos ubiquitinés par :
- le domaine UEV de TSG101/Vps23 qui peut aussi s'ancrer aux cargos ubiquitinés (Structure and functional interactions of the Tsg101 UEV domain 2002),
- le domaine SOUBA C-terminal de UBAP1 (The UBAP1 Subunit of ESCRT-I Interacts with Ubiquitin via a SOUBA Domain 2012),
- le domaine C-terminal de MVB12 (ESCRT ubiquitin-binding domains function cooperatively during MVB cargo sorting 2009).
3. Le domaine C-terminal de la sous-unité VPS28 de l'ESCRT-I se lie à l'ESCRT-II.
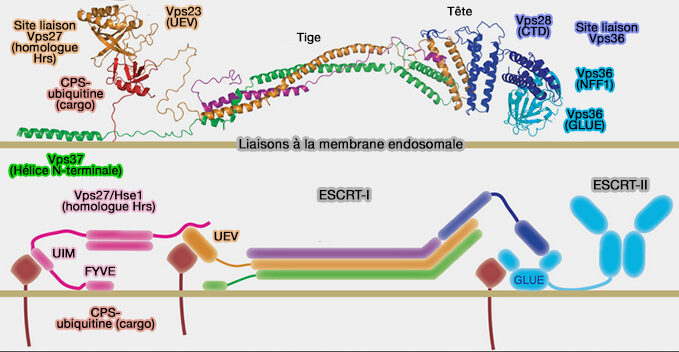
(Figure : vetopsy.fr d'après Kostelansky et col)
4. La liaison du complexe aux phospholipides membranaires endosomaux est effectuée par :
- MVB12, via son domaine MABP (Structural basis for membrane targeting by the MVB12-associated β-prism domain of the human ESCRT-I MVB12 subunit 2012),
- VPS37 par ses hélices N-terminales.
ESCRT-II
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


