Fission membranaire
Fission membranaire des lysosomes
Vue d'ensemble et vésiculation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La fission des lysosomes peut être réalisée par plusieurs mécanismes.
Les MCS RE/endosomes/lysosomes sont souvent le site de la fission des lysosomes.
- Plus de 90% des endosomes tardifs/lysosomes sont associés au réticulum endoplasmique (RE).
- 80% des événements de fission endosomale se produisent lorsqu'ils sont associés au RE.
- Ce processus doit aussi jouer un rôle dans le tri des cargos.

Les fissions spécifiques seront le plus souvent étudiées dans des chapitres particuliers.
Vue d'ensemble de la fission des lysosomes
La fission des lysosomes est cruciale pour maintenir des niveaux stables de nombre et de taille de lysosomes.
Les lysosomes peuvent bourgeonner et subir des fissions, i.e. se séparer en deux organites, par plusieurs mécanismes (

Vous pouvez lire les articles : Lysosome Fission: Planning for an Exit (2019) et Lysosomal Biology and Function: Modern View of Cellular Debris Bin (2020).
1. La fission lysosomale peut provoquer la formation :
- d'une vésicule détachée directement à partir du lysosome ou à partir de l'extrémité d'un tubule du lysosome,
- d'un tubule qui peut se séparer du lysosome,
- de deux lysosomes par fission équatoriale.
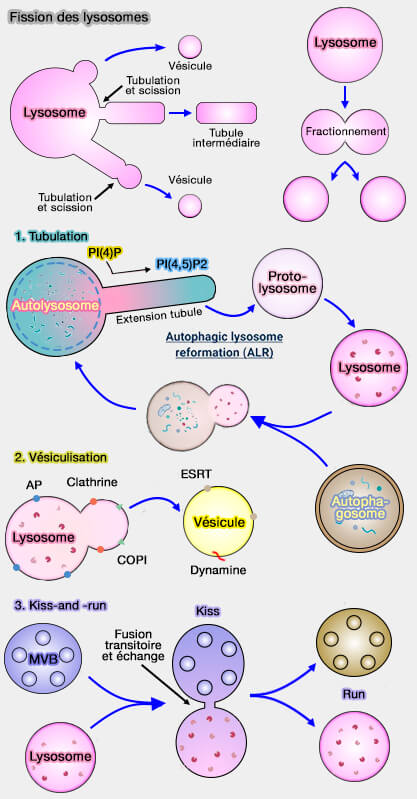
(Figure : vetopsy.fr d'après Trivedi et coll et Saffti et coll)
Ces processus font partie d'un continuum et dépendent de plusieurs processus :
- une fission précoce provoque la formation d'une vésicule,
- une fission tardive, celle d'un tubule (Resolution of macropinosomes, phagosomes and autolysosomes: Osmotically driven shrinkage enables tubulation and vesiculation 2018).
2. Les lysosomes peuvent entrer de manière transitoire en contact par leur membrane plasmique avec d'autres organites, i.e. par un petit pore de fusion qui permet l'échange de molécules (kiss), et se séparent (run) rapidement (
Vésicularisation
des lysosomes
Mécanisme classique
Les molécules classiques de la formation des vésicules sont recrutées par les lysosomes, i.e. adaptateurs qui trient les cargos, manteaux de clathrine ou de COPII qui courbent la membrane et molécules de fission comme la dynamine qui libèrent la vésicule.
La déplétion des adaptateurs ou de la dynamine augmentent la taille des lysosomes (Loss of AP-5 results in accumulation of aberrant endolysosomes: defining a new type of lysosomal storage disease 2015).
1. Toutefois, ces assemblées sur les lysosomes paraissent insuffisantes pour provoquer une vésicularisation.
- En effet, la clathrine forme de grandes cages plates ou même des bicouches d'échafaudages qui régulent plutôt le tri des cargos sur des endosomes plutôt que leur vésiculation.
- La clathrine a recours à la protéine Hrs de ESCRT-0 pour la maturation des endosomes précoces et pour aider à la scission membranaire dite " inversée ", nécessaire à la formation des vésicules intraluminales (ILV).
2. La clathrine et les adaptines (AP) sont nécessaires à la formation des tubules des lysosomes et/ou des autolysosomes, plutôt qu'à la formation de petites vésicules (
Spatacsine et spastizine
1. La spatacsine/SPG11 et la spastizine/SPG15 forment ou font partie d'un manteau spécifique aux lysosomes qui provoque la fission, soit par vésiculation et/ou tubulation.
Ce sont de grandes protéines qui comprennent des domaines α-solénoïdes, également trouvés sur la chaîne lourde de la clathrine et sur COPI (Lysosomal abnormalities in hereditary spastic paraplegia types SPG15 and SPG11 2014).
- Elles font partie d'un complexe qui entre en interaction avec AP-5 (Interaction between AP-5 and the hereditary spastic paraplegia proteins SPG11 and SPG15 2013).
-
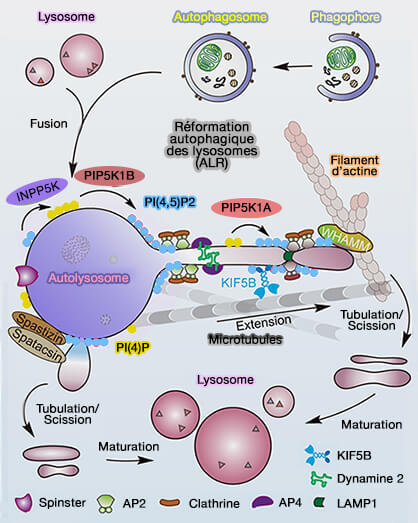
Reformation autophagique des lysosomes (ALR)
(Figure : vetopsy.fr d'après Yang et Wang)
2. La reformation autophagique des lysosomes (ALR) impliquerait probablement des facteurs supplémentaires.
- Par exemple, les mutations de la spastizine/SPG15 et de la spatacsine/SPG11, ainsi que des sous-unités d'AP-5 (AP5Z1), sont responsables de deux formes héréditaires autosomiques récessives courantes de paraplégie spastique, forment un complexe qui se localise dans les lysosomes via le domaine FYVE de la spastizine, qui favorise l'initiation des tubules sur l'autolysosome (Spastic paraplegia proteins spastizin and spatacsin mediate autophagic lysosome reformation 2014).
- La manière dont le complexe spastizine-spatacsine coopère avec l'axe PI(4,5)P2 ou PIP2/clathrine pour réguler l'ALR est encore discutée.
3. La spatacsine/SPG11 et la spastizine/SPG15 et AP-5 contrôlent probablement l'état d'équilibre des fonctions lysosomales, et pas seulement la dynamique des autolysosomes, car elles sont localisées sur les lysosomes libres, i.e. non fusionnés avec les autophagosomes, et leur suppression réduit le nombre et augmente la taille des lysosomes (Spastic paraplegia proteins spastizin and spatacsin mediate autophagic lysosome reformation 2014).
Toutefois, la paraplégie spastique héréditaire est associée à une soixantaine de mutations, i.e. sous-unités d'AP-4, d'ESCRT-II, de WASH, de kinésines et de protéines endoplasmiques et mitochondriales (Converging cellular themes for the hereditary spastic paraplegias 2018).
Lyst1
En outre, des protéines qui ont des rôles contradictoires dans la fusion et la fission des lysosomes, comme Lyst1 (LYSososmal-Trafficking regulator) pourraient former des échafaudages.
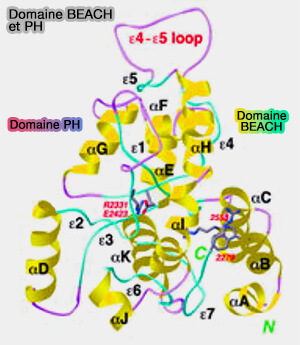
(Figure : vetopsy.fr d'après Jogl et Coll)
1. Lyst1 fait partie des protéines BDCP (BEACH Domain Containing Proteins) qui contiennent un domaine BEACH (Beige and Chediak-Higashi), i.e. domaine d'environ 280 résidus (The BEACH is hot: A LYST of emerging roles for BEACH-domain containing proteins in human disease 2013).
" Beige " est l'autre nom du syndrome CHS chez la souris.
Ces protéines contiennent, en outre, un domaine PH très proche de BEACH et des répétitions WD40.
- Les domaines PH et BEACH cibleraient les membranes spécifiques des compartiments.
- Les domaines WD40 rentreraient en interaction pour former l'échafaudage.
2. Lyst1 pourrait intervenir dans le modèle " kiss-and-run " qui permet une fusion partielle et coordonner la fission (The enlarged lysosomes in Beigej cells result from decreased lysosome fission and not increased lysosome fusion 2012 et LYST Affects Lysosome Size and Quantity, but not Trafficking or Degradation Through Autophagy or Endocytosis 2014).
On pourrait imaginer un échafaudage d'un complexe semblable au porosome et Lyst1, une structure en coupe qui serait intégrée dans la membrane plasmatique et dans laquelle une vésicule exocytaire s'amarrerait pour former un tunnel à travers lequel s'écoulerait le contenu.
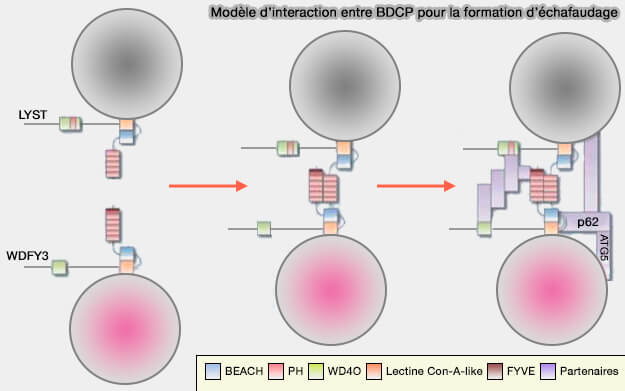
(Figure : vetopsy.fr d'après Cullinane et coll)
3. LYST est le gène muté dans le syndrome de Chediak-Higashi (CHS), qui est une maladie autosomique récessive rare qui peut provoquer une immunodéficience sévère, une hypopigmentation des yeux et de la peau, des saignements prolongés et des symptômes neurologiques chez l'homme (The road to lysosome-related organelles: Insights from Hermansky-Pudlak syndrome and other rare diseases 2019).
Remarque : d'autres protéines pourraient intervenir, comme la nexine SNX4 (Membrane protein recycling from the vacuole/lysosome membrane 2018).
Tubulation des lysosomes et mécanisme de fission
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


