Enzymes
Groupe des
transférases (EC 2)
Protéine kinases : vue d'ensemble
et classification
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les protéine kinases sont des enzymes spécifiques du groupe des transférases (EC 2) catalysant les réactions de phosphorylation par l'ajout d'un groupe phosphate à des protéines à partir de l'ATP.
Les protéine phosphatases, au contraire, déphosphorylent la protéine cible en lui retirant son groupe phosphate.

Ces phosphorylations/déphosphorylations régulent un grand nombre de protéines en servant de commutateur on/off et régulant la majorité des voies cellulaires, en particulier celles impliquées dans la transduction d'un signal.
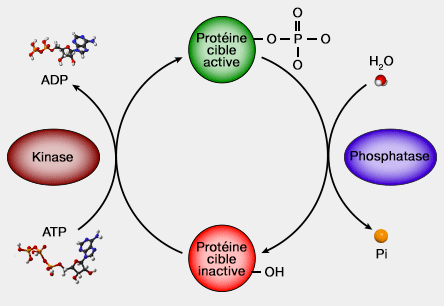
(Figure : vetopsy.fr)
Vue d'ensemble
des protéine
kinases
1. La phosphorylation des protéines par les kinases, processus qui concerne environ 30% des protéines, peut modifier la fonction d'une protéine de plusieurs façons :
- en augmentant ou en diminuant son activité,
- en la stabilisant,
- en la localisant dans un compartiment cellulaire spécifique
- en initiant ou en perturbant son interaction avec d'autres protéines,
- en la marquant pour sa destruction.
2. Les protéines cellulaires peuvent subir de multiples modifications covalentes, mais la phosphorylation est une des rares à être réversible, i.e. elle peut servir de régulation.
- Comme les kinases et les phosphatases sont souvent actives simultanément et qu'aucune nouvelle protéine n'a besoin d'être synthétisée, la phosphorylation réversible est rapide et a généralement un taux de renouvellement élevé.
- Les protéines kinases et les phosphatases (ptases) constituent 2 à 4 % des gènes d'un génome eucaryote typique, et représente un moyen important et ancien conservé par l'évolution.
- La phosphorylation des protéines se produit beaucoup plus fréquemment dans les cellules eucaryotes que dans les cellules procaryotes pour répondre à un plus large éventail de signaux
Edwin Krebs (1918-2009), i.e. rien à voir avec Hans Adolf Krebs, découvreur du cycle de Krebs, a affirmé que le contrôle allostérique évoluait pour répondre aux signaux provenant de l'intérieur de la cellule, tandis que la phosphorylation évoluait pour répondre aux signaux extérieurs à la cellule (The phosphorylation of proteins: a major mechanism for biological regulation 1985).
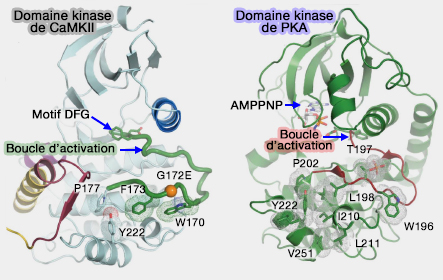
(Figure : vetopsy.fr d'après Chao et Stratton)
3. Les protéines peuvent servir de substrats à plusieurs kinases.
- Les PK sont en général nommées en fonction de la molécule qui régule leurs activités, par exemple, les CaM kinases ou Ca++/calmoduline-dépendantes (EC 2.7.11.17).
- Parfois, elles peuvent être encore subdivisés en catégories car elles comportent plusieurs formes isoenzymatiques. Par exemple, les protéines kinases dépendantes de l'AMP cyclique ou PKA de type I et de type II (EC 2.7.11.11) ont des sous-unités catalytiques identiques, mais des sous-unités régulatrices différentes qui se lient à l'AMP cyclique (Protein Kinase A Type I and Type II Define Distinct Intracellular Signaling Compartments 2008).
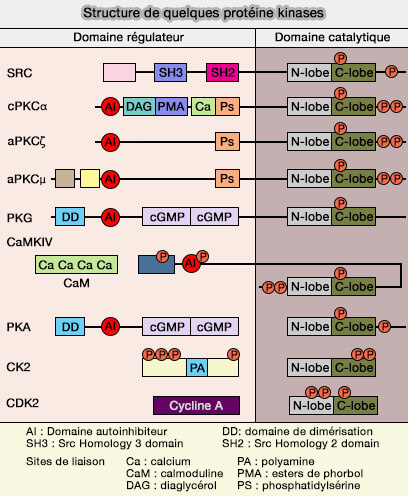
(Figure : vetopsy.fr d'après Reikhardt et coll)
4. Les kinases peuvent être :
- isolées,
- liées à un récepteur membranaire ,
- faisant partie intégrante d'un récepteur membranaire comme les RTK (Receptor Tyrosine Kinase) par exemple.
5. Les protéines kinases sont enzymes clefs du signal intracellulaire, i.e. leur domaine catalytique permet d'exécuter leurs fonctions précises en fonction du lieu et de l'heure.
En outre, de nombreuses PK possèdent des domaines régulateurs.
- En général, ce domaine inhibe la PK, comme dans la PKC, la PKG et CaMKII en agisant comme un pseudo-substrat.
- La liaison avec les effecteurs, i.e. Ca++, cAMP/cGMP, phospholipides, abolit cet effet et active la kinase. Par contre, les CaMK ne peuvent se lier au Ca++ et doivent utiliser la calmoduline.
- Les sites de phosphorylation/déphosphorylation sont aussi des régulateurs puissants dans de nombreuses PK, par exemple des voies de signalisation comme celles des petites GTPases provoquent une cascade d'événements,.
- Les kinases peuvent également s'autoréguler par différents processus.
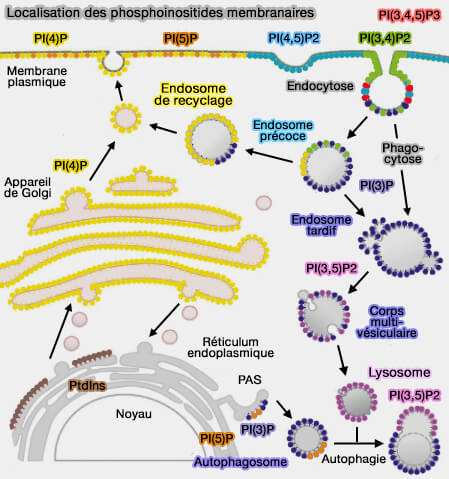
(Figure : vetopsy.fr d'après Cernikova et coll)
6. Les protéines kinases doivent se localiser à des endroits précis de la cellule : elles doivent s'associer à d'autres composants.
Les différents phosphoinositides les localisent aux diverses membranes, à travers les domaines HH, C1, C2, PX et FERM,
Les protéines d'échafaudage, les chaperons et les protéines adaptatrices entrent en interaction avec elles par (Assembly of Cell Regulatory Systems Through Protein Interaction Domains 2003) :
- leur domaine SH3, SH2 ou 14-3-3, qui reconnaissent des motifs PxxP ou pSer/p/Tyr,
- leurs domaines DD (Dimerization domain), PDZ ou SAM qui contactent les mêmes domaines…
Remarque : les protéines 14-3-3 forment une famille de molécules exprimées dans toutes les cellules eucaryotes qui ont la capacité de se lier à une multitude de protéines de signalisation, comme les kinases, les phosphatases, et les récepteurs transmembranaires.
Classification des protéine kinases

La plupart des protéines kinases sont étudiées dans un chapitre spécifique.
Chez l'homme, on compte près de 518 protéine kinases dont 478 conserve le domaine catalytique de la PKA, les 40 autres ont un domaine catalytique différent.
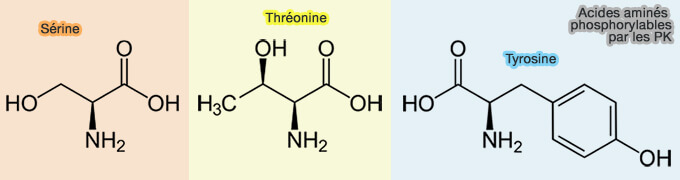
1. Chez l'homme, par exemple, las acides aminés phosphorylés par les kinases sont (Global, In Vivo, and Site-Specific Phosphorylation Dynamics in Signaling Networks 2006) :
Remarque : La phosphorylation de l'histidien est moins fréquente chez les eucaryotes (
2. Les kinases se lient aussi à des groupes d'acides aminés entourant le résidu phosphorylé.
(Figure : vetopsy.fr d'après Chao et Stratton)
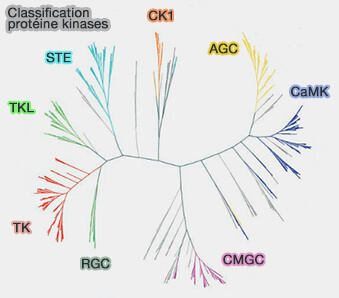
Classification selon l'évolution
Les protéines kinases peuvent être classées en 8 groupes principaux (The protein kinase complement of the human genome 2002).
(Figure : vetopsy.fr)
1. la famille des AGC (PKA, PKG, et PKC…),
2. la famille des CaMK (Ca++/calModulin dependent Kinases),
3. la famille des CK1 (Casein Kinase 1),
4. la famille des CMGC qui comprend :
- les CDK (Cyclin-Dependent Kinases)
- les MAPK (Mitogen Activated Protein Kinases),
- les GSK (Glycogen Synthase Kinases),
- les CDK like,
5. la famille des STE (kinases en amont de la voie MAPK, analogue à la PK STE de la levure),
6. la famille TK (Tyr Kinases),
7. la famille TKL (TK Like kinases),
8. la famille RGC family (Receptor Guanylate Cyclases comprenant un domaine TK).

Pour une figure plus grande avec les kinases, voir : Protein Kinases: Evolution of Dynamic Regulatory Proteins (2011).
Classification suivant l'acide aminé phosphorylé
Sérine/thréonine kinases
Les sérine/thréonine kinase (EC 2.7.11) ajoutent un groupe phosphate au groupes hydroxyles (-OH) de la sérine ou/et de la thréonine.
$\ce{ATP + protéine}$ $\leftrightharpoons$ $\ce{ADP + phosphoprotéine}$
Tyrosine kinases
Les tyrosine kinases ajoutent un groupe phosphate au groupe hydroxyle (-OH) de la tyrosine, et comprennent deux sous familles :
- les RTK (Receptor Tyrosine Kinases), récepteurs membranaires tyrosine kinase (EC 2.7.10.1),
- les nRTK (non-Receptor Tyrosine Kinases) cytosoliques, même si certaines sont ancrées à la membrane cellulaire par modification post-traductionnelle N-terminale (EC 2.7.10.2).
$\ce{ATP + [protéine]-L-tyrosine}$ $\leftrightharpoons$ $\ce{ADP + [protéine]-L-tyrosine phosphate}$

Malgré leur faible contribution à la phosphorylation totale des protéines, leur rôle est essentiel dans l'oncogenèse.
DSK (Dual-Specific Kinases)
Les dual-specific kinases ou DSK (EC 2.7.12.1), sont à la fois des sérine/thréonine kinases et des tyrosine kinases
Histidine kinases
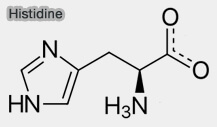
Les histidine kinase (EC 2.7.13.3), retrouvées principalement chez les Procaryotes, ajoutent un groupe phosphate au groupe hydroxyle (-OH) de l'histidine.
$\ce{ATP + [protéine]-L-histidine}$ $\leftrightharpoons$ $\ce{ADP + [protéine]-N-phospho-L-histidine}$
Domaine protéine kinase
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesProtéines kinasesLipides kinasesHydrolasesPeptidases/protéasesPhosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


