Enzymes
Groupe des hydrolases (EC 3)
Phosphatases : lipide phosphatases
Phosphoinositide 5-phosphatases de type II
Synaptojanines
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les PI 5-phosphatases, encore appelées inositol polyphosphate 5-phosphatases (INPP5) sont des phosphatidylinositol phosphatases (PI phosphatases) qui retirent le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol des phosphoinositides.
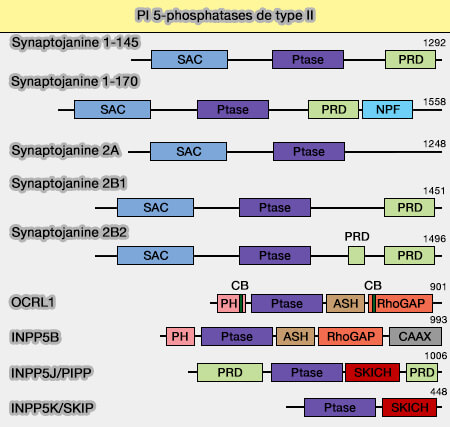
Les PI 5-phosphatases de type II comprennent :
- les synaptojanines,
- OCRL1 (Oculo-Cerebro-Renal syndrome of Lowe),
- INPP5B,
- INPP5J/PIPP,
- INPP5K/SKIP.

Vous pouvez lire : The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis (2015) et Phosphatidylinositol Kinases and Phosphatases in Entamoeba histolytica (2019).
Synaptojanines
(Figure : vetopsy.fr d'après Nakada-Tsukui et coll)
Deux synaptojanines sont retrouvées chez les mammifères avec de nombreuses versions d'épissage.
Structure
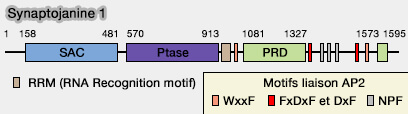
Les synaptojanines comprennent plusieurs domaines
1. Le domaine Sac N-terminal conservé a une activité d'inositol phosphatase, qui leur permet de déphosphoryler PI(3)P, PI(4)P et PI(3,5)P2.
Le domaine Sac utiliserait le produit généré par le domaine PI 5-phosphatase pour finalement générer des PI (Functional Characterization of a Mammalian Sac1 and Mutants Exhibiting Substrate-specific Defects in Phosphoinositide Phosphatase Activity 2001).
2. Le domaine catalytique 5-Ptase leur permet de déphosphoryler l'hydroxyle 5 du noyau de l'inositol d'Ins(1,4,5)P3, d'Ins(1,3,4,5)P4, de PI(4,5)P2 ou PIP2 et de PI(3,4,5)P3 ou PIP3.
3. Le domaine C-terminal variable selon l'épissage, mais avec la plupart du temps, un domaine riche en proline (PRD).
(Figure : vetopsy.fr)
Ce domaine comprend des motifs peptidiques à l'origine de liaisons avec une grande variété de protéines endocytaires.
Remarque : Les SYNJ de la levure possèdent un domaine de liaison à l'ARN (RBD) après leur domaine 5-ptase, qui ne semble pas retrouvé chez le homologues, mais cette notion est controversée.
Rôles
Endocytose
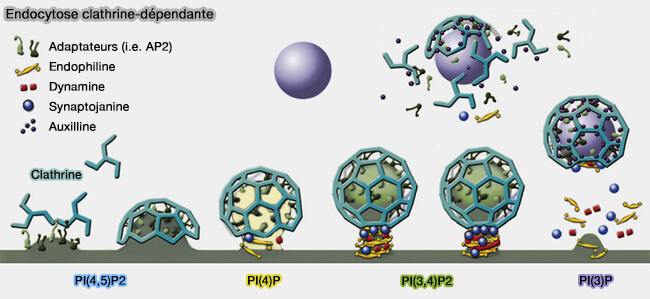
1. Les synaptojanines jouent un rôle essentiel dans la formation et le déshabillage des vésicules de clathrine (CCV).
L'élimination de SYNJ1 chez la souris a entraîné une accumulation de CCV endocytosées et un mauvais recyclage des vésicules dans le pool de vésicules synaptiques compétentes pour la fusion (Delayed reentry of recycling vesicles into the fusion-competent synaptic vesicle pool in synaptojanin 1 knockout mice 2002).
(Figure : vetopsy.fr d'après Milosevic et coll)
L'endophiline interagit avec d'autres protéines par ses domaines SH3 pour initier des fosses peu profondes recouvertes de clathrine (Synaptojanin Is Recruited by Endophilin to Promote Synaptic Vesicle Uncoating 2003).
- L'endophiline, par son domaine SH3, interagit avec le domaine PRD de SYNJ1 et/ou la parkine, une E3 ubiquitine ligases de la famille RBR.
- LRRK2 (Leucine-Rich Repeat Kinase 2, appelée aussi dardarine ou PARK8) phosphoryle l'endophiline conduisant à la dissociation de cette dernière des vésicules recouvertes de clathrine.
- Une fois recruté dans les vésicules contenant de l'endophiline, SYNJ1 déphosphoryle PI(4,5)P2 ou PIP2 en PtdIns ou phosphatidylinositol, éliminant la clathrine et son adaptateur de la bicouche.
- Le déshabillage des vésicules nécessite des protéines chaperons comme Hsc70 et des co-chaperons comme l'auxiline/GAK.
- Puis, les vésicules post-endocytaires peuvent retourner dans le pool de réserve, où elles subissent un regroupement, ou retourner directement au site de libération et entrer dans une étape d'exocytose.
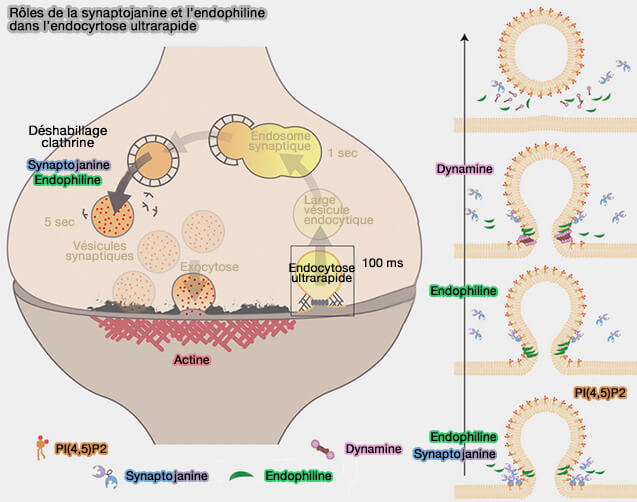
(Figure : vetopsy.fr d'après Watanabe et coll)
2. L'endocytose ultrarapide (UFE), survenant dans l'hippocampe, génère des vésicules à partir de la membrane plasmique en 50 ms après la fusion des vésicules synaptiques (Synaptojanin and endophilin mediate neck formation during ultrafast endocytosis 2018).
- En l'absence de synaptojanine ou d'endophiline, la membrane s'invagine rapidement, mais les cavités ne se resserrent pas à la base.
- L'activité 5-phosphatase de la synaptojanine est impliquée dans la formation du cou, mais la 4-phosphatase n'est pas requise.
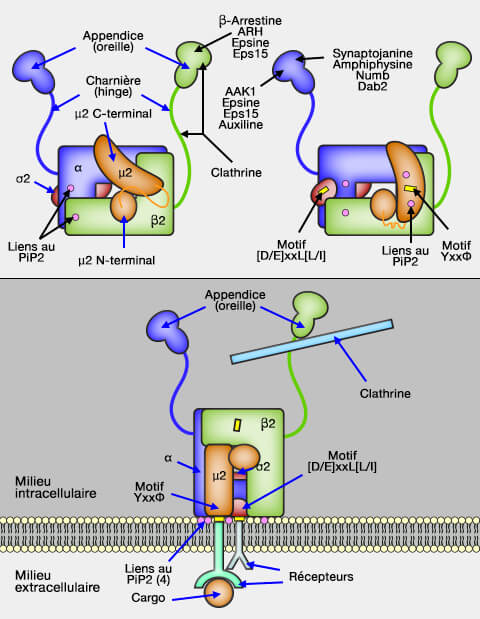
Endocytose et domaines BAR ou SH3
Les synaptojanines sont impliquées dans l'endocytose et le recyclage des vésicules synaptiques avec une variété de protéines de liaison endocytaires qui possèdent souvent :s
- un domaine BAR,
- et/ou un domaine SH3 comme l'endophiline (Identification of the Major Synaptojanin-binding Proteins in Brain 1997).
(Figure : vetopsy.fr d'après Quan et coll)
1. L'amphiphysine courbe les membranes (Amphiphysin I Is Associated with Coated Endocytic Intermediates and Undergoes Stimulation-dependent Dephosphorylation in Nerve Terminals 1997),
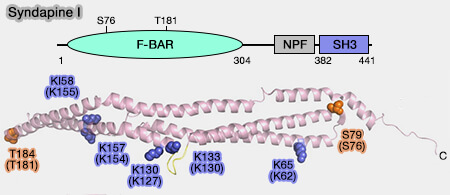
2. Les syndapines ou PACSINes, protéines associées à la dynamine synaptique ou aux protéines EHD, en particulier EHD2 dans l'endocytose cavéole-dépendante à rôle important dans les synapses.

Les syndapines ou PACSINes sont étudiées dans un chapitre spécifique.
(Figure : vetopsy.fr)
3. En outre, la SYNJ1-170 contient aussi une répétition de domaines NPF.
Ces répétitions sont impliquée dans l'interaction avec :
- le domaine EH (homologie Eps15), le domaine auriculaire du composant α-adaptine du complexe de la protéine adaptatrice AP-2 (Stimulation of phosphatidylinositol kinase type I-mediated phosphatidylinositol (4,5)-bisphosphate synthesis by AP-2μ–cargo complexes 2006),
- le domaine N-terminal de la chaîne lourde de la clathrine (EHD Proteins Associate with Syndapin I and II and Such Interactions Play a Crucial Role in Endosomal Recycling 2005).

Les protéines EHD sont étudiées dans un chapitre spécifique
3. L'intersectine/Dap160 est une protéines d'échafaudage qui recrute l'actine.
4. La dynamine, i.e. GTPase, sépare la vésicule de la membrane neuronale et joue un rôle dans le recyclage des protéines membranaires et des récepteurs du facteur de croissance (The SH3p4/Sh3p8/SH3p13 protein family: Binding partners for synaptojanin and dynamin via a Grb2-like Src homology 3 domain 1997).
Mutations des synaptojanines et maladies neuronales
- Des mutations des synaptojanines sont liées à plusieurs maladies neuronales.
1. La surexpression de SYNJ1 résultant de la duplication trisomique peut contribuer au dysfonctionnement cérébral dans :
- le syndrome de Down ou trisomie 21 (Synaptojanin 1-linked phosphoinositide dyshomeostasis and cognitive deficits in mouse models of Down's syndrome 2008),
- le trouble bipolaire (Mutation analysis of SYNJ1: a possible candidate gene for chromosome 21q22-linked bipolar disorder 2001).
2. De plus, une mutation dans le domaine Sac1 est liée à un parkinsonisme progressif précoce (The Sac1 Domain of SYNJ1 Identified Mutated in a Family with Early-Onset Progressive Parkinsonism with Generalized Seizures 2013 et Synaptojanin 1 Mutation in Parkinson's Disease Brings Further Insight into the Neuropathological Mechanisms 2013).
OCRL1 et INPP5B
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesHydrolasesPeptidases/protéasesPhosphatasesProtéine phosphatasesPI phosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


