Système endo-lysosomal
Lysosomes
Calcium lysosomal
- Vue d'ensemble du système endomembranaire
- Endosomes
- Lysosomes
- Vue d'ensemble
- Structure des lysosomes
- Fonctions des lysosomes
- Biogenèse des lysosomes
- Biogenèse par livraison des protéines et fusion
- Biogenèse par reformation (fission)
- Biogenèse par régulation transcriptionnelle (TFEB/TFE3/TFEC)
- LRO (Lysosome-Related Organelles)
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Dans les cellules de mammifères, les endo-lysosomes, en plus du réticulum endoplasmique (RE) et des mitochondries, remplissent également des fonctions de stockage du calcium, appelées réserves de calcium acide.
Vue d'ensemble
1. La concentration de Ca++ dans la lumière du lysosome est estimée à environ 500µM.
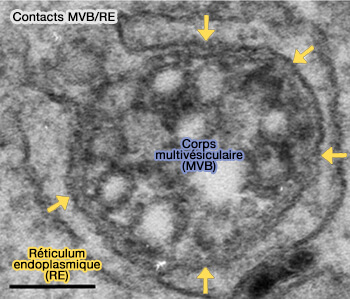
(Figure : vetopsy.fr d'après Wong et coll)
NAADP (Nicotinic Acid Adenine Dinucleotide Phosphate), l'un des seconds messagers mobilisateurs de Ca++ les plus puissants, pourrait libérer le Ca++, comme d'autres signaux intracellulaires (NAADP mobilizes calcium from acidic organelles through two-pore channels 2009).
Remarque : dans des conditions de repos, Ca++ cytosolique libre est maintenu à un niveau très bas (100 nM), qui est environ 20 000 fois inférieur au Ca++ extracellulaire et environ 5 000 fois inférieur aux réserves intracellulaires du réticulum endoplasmique (RE), des endosomes et des lysosomes.
2. La libération locale de Ca++ par les canaux ioniques et les transporteurs des lysosomes est cruciale pour (Calcium at the Center of Cell Signaling: Interplay between Endoplasmic Reticulum, Mitochondria, and Lysosomes 2016) :
- la régulation de la dynamique des membranes endosomes tardifs/lysosomes, lysosome/membrane plasmique et lysosome/autophagosome,
- la reformation lysosomale endocytaire (ELR) et phagocyaire (PLR).
- la signalisation globale du Ca++ en interagissant avec la signalisation calcique du réticulum endoplasmique (Calcium at the Center of Cell Signaling: Interplay between Endoplasmic Reticulum, Mitochondria, and Lysosomes 2016).
En outre, lors de lésion, l'efflux de calcium des endosomes endommagés sert de signal pour déclencher un processus de réparation membranaire médié par le complexe ESCRT (Triggered recruitment of ESCRT machinery promotes endolysosomal repair 2018).
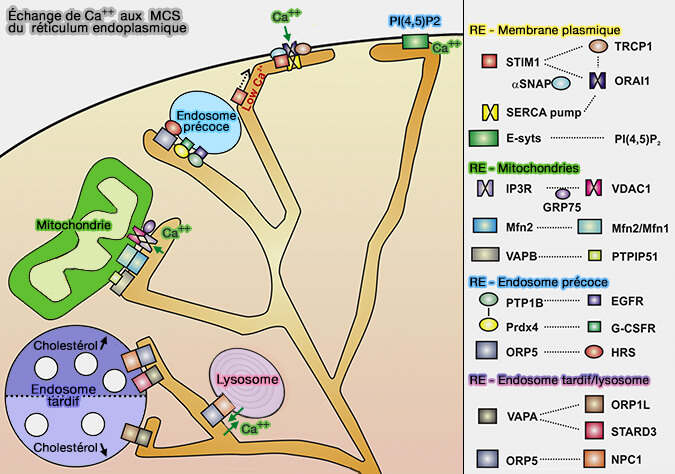
(Figure : vetopsy.fr d'après Burgoyne et coll)
3. La régulation de Ca++ est vraisemblablement effectuée via les sites de contact de la membrane RE-endosome (Lysosomal Calcium in Neurodegeneration 2016 et Calcium signaling at ER membrane contact sites 2016).

Les sites de contact membranaire (MCS) sont étudiés dans un chapitre spécial.
Les sites de contact membranaire sont stabilisés par de nombreux complexes d'attache ou d'amarrage qui maintiennent une proximité étroite entre les membranes apposées sans fusion membranaire (
On en voit un exemple dans les échanges de calcium dans la figure ci-dessus.
Canaux calciques lysosomaux
Les canaux calciques lysosomaux peuvent également fonctionner comme des régulateurs clés du trafic endo-lysosomal et des processus liés à l'autophagie (Lysosomal calcium signaling regulates autophagy via calcineurin and TFEB 2015).
TRPML1
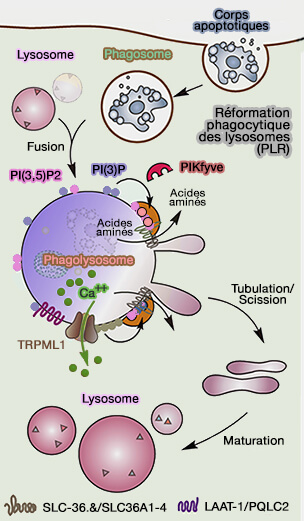
des lysosomes (PLR)
(Figure : vetopsy.fr d'après Yang et Wang)
1. Les canaux calciques TRPML appartiennent à :
- la famille des canaux ioniques TRP - Transient Recepteur Potentiel - (
classification des canaux TRP ou Transient Recepteur Potentiel),
- au sous-groupe mucolipine, d'où ML (An introduction to TRP channels 2006 et TRPML1 is a member of the Transient Receptor Potential ion channel superfamily 2021).
On trouve trois isoformes de TRPML chez les mammifères :
- TRPML1 est largement exprimé et principalement localisé sur les endosomes tardifs et les lysosomes,
- TRPML2 et TRPML3 sont exprimés sur les endosomes précoces et les endosomes de recyclage, mais aussi dans les endosomes tardifs et les lysosomes.
2. TRPML1 est un canal cationique non sélectif perméable au Ca++ qui peut être activé par PI(3,5)P2, un phospholipide enrichi sur les membranes endosomales tardives et lysosomales (The Type IV Mucolipidosis-Associated Protein TRPML1 is an Endo-lysosomal Iron Release Channel 2010).
- Dans la phagocytose, l'activation de TRPML1 provoque la libération de Ca++ lysosomal, livrant les lysosomes aux sites des phagosomes naissants pour favoriser l'ingestion phagocytaire de grosses particules extracellulaires telles que les cellules apoptotiques (A TRP channel in the lysosome regulates large particle phagocytosis via focal exocytosis 2013).
- De même, TRPML1 est nécessaire pour la réparation membranaire dans les muscles, i.e. sa délétion est à l'origine d'atrophie musculaire squelettique et de faiblesse (An Intracellular Ca2+ Channel is Required For Sarcolemma Repair to Prevent Muscular Dystrophy 2014).
Les canaux TRPML sont responsables :
- de la mucolipidose, LSD de type 4, lors de mutation, i.e. maladie caractérisée par l'accumulation cytoplasmique de corps d'inclusion avec plusieurs membranes lamellaires et un stockage de lipides et de protéines dans les lysosomes (Fusion of lysosomes with secretory organelles leads to uncontrolled exocytosis in the lysosomal storage disease mucolipidosis type IV 2016 et Current concepts in the neuropathogenesis of mucolipidosis type IV 2018),
- de la pénétration du virus Ebola dans les endo-lysosomes dans les cellules hôtes (Two pore channels control Ebolavirus host cell entry and are drug targets for disease treatment 2015).
Ces fonctions de TRPML1 sont principalement attribuées à un trafic membranaire constitutif altéré qui implique les lysosomes et qui se produit sur une échelle de temps de plusieurs minutes à plusieurs heures.
3. Or, il semblerait que la délétion de Trpml1 provoque une augmentation marquée de toutes les formes d'exocytose régulée, probablement due à la fusion des lysosomes avec des organites sécrétoires pour agrandir leur taille (Fusion of lysosomes with secretory organelles leads to uncontrolled exocytosis in the lysosomal storage disease mucolipidosis type IV 2016).

Un des rôles majeurs de TRPML1 serait de prémunir la fusion involontaire et pathologique des lysosomes avec d'autres organites intracellulaires qui, dans les cellules sécrétoires, incluent les organites sécrétoires.
4. TRPML est sous le contrôle de TFEB (Transcription Factor EB), le maître principal régulant la biogenèse de lysosomes et l'autophagie (
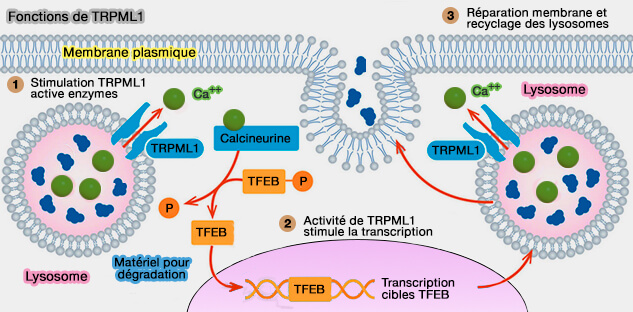
(Figure : vetopsy.fr d'après caraway.tx.com)
5. La libération de Ca++ lysosomal médiée par TRPML1 peut remplir diverses fonctions physiologiques :
- l'exocytose lysosomale (A TRP channel in the lysosome regulates large particle phagocytosis via focal exocytosis 2013),
- la réparation membranaire (An Intracellular Ca2+ Channel is Required For Sarcolemma Repair to Prevent Muscular Dystrophy 2014),
-
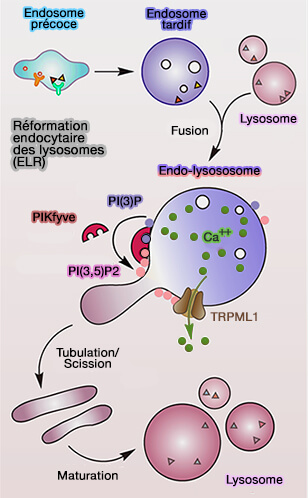
Reformation endocytaire
des lysosomes (ELR)
(Figure : vetopsy.fr d'après Yang et Wang) - la détection des nutriments (Up-regulation of lysosomal TRPML1 channels is essential for lysosomal adaptation to nutrient starvation 2015),
- la détection du stress oxydatif (MCOLN1 is a ROS sensor in lysosomes that regulates autophagy 2016),
- le positionnement, la tubulation et la reformation des lysosomes par fission (A Molecular Mechanism to Regulate Lysosome Motility for Lysosome Positioning and Tubulation 2016).
TPC (canaux à deux pores)
1. Les canaux TPC (Two-Pore Channels), de la famille des canaux CNG (Cyclic Nucleotide–Gated) contiennent deux tandems à six domaines transmembranaires et sont retrouvés sous deux isoformes.
- TPC1 est exprimée à la fois dans les endosomes précoces et les lysosomes.
- TPC2 est principalement présente sur les membranes lysosomales.

Les canaux TCP sont étudiés dans un chapitre spécial.
2. Malgré des controverses, les TPC ont des rôles physiologiques importants comme (Acidic calcium stores open for business: expanding the potential for intracellular Ca2+ signaling 2015) :
- la régulation de l'autophagie dans les cardiomyocytes (Endolysosomal two-pore channels regulate autophagy in cardiomyocytes 2016),
-
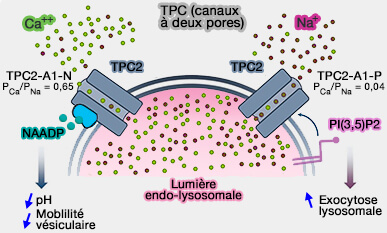
Canaux TPC (Two-Pore Channels)
(Figure : vetopsy.fr d'après Stoklosa et Coll) - la régulation de l'infection par le virus Ebola (Two pore channels control Ebolavirus host cell entry and are drug targets for disease treatment 2015),
- l'endurance physique pendant la restriction nutritionnelle (mTOR Regulates Lysosomal ATP-Sensitive Two-Pore Na+ Channels to Adapt to Metabolic State 2013).
Autres canaux
Bien qu'on les trouve sur les membranes lysosomales, les études électrophysiologiques directes de ces autres canaux calciques font encore défaut.
1. P2X4 est un canal cationique dépendant de l'ATP qui appartient aux récepteurs ionotropes de la famille P2X de l'ATP (A role for P2X4 receptors in lysosome function 2019 et P2X4 and lysosome fusion 2019).
- P2X4 a été retrouvé sur les membranes plasmiques et lysosomales (Regulation of P2X4 receptors by lysosomal targeting, glycan protection and exocytosis 2007).
- L'ATP, le ligand naturel de P2X4, s'est avéré s'accumuler dans les lysosomes (Activation of lysosomal P2X4 by ATP transported into lysosomes via VNUT/SLC17A9 using V-ATPase generated voltage gradient as the driving force 2016).
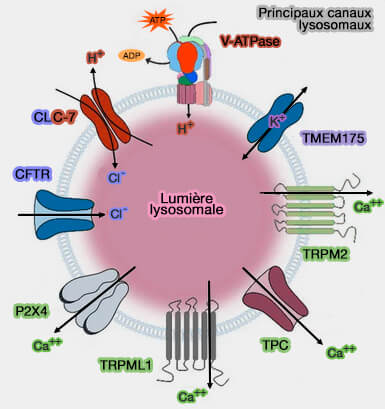
(Figure : vetopsy.fr d'après Lee et Hong)
Toutefois, même en présence d'ATP, l'activité P2X4 est inhibée par le pH acide lysosomal.
- L'alcalinisation luminale pourrait contrecarrer cette inhibition, permettant ainsi la libération lysosomale de Ca++ via P2X4 (P2X4 Forms Functional ATP-activated Cation Channels on Lysosomal Membranes Regulated by Luminal pH 2014).
- Le P2X4 lysosomal s'est avéré être impliqué dans la fusion de la membrane lysosomale de manière dépendante de la calmoduline (Calcium release through P2X4 activates calmodulin to promote endolysosomal membrane fusion 2015).
Remarque : la libération de Ca++ par les canaux P2X4 favoriserait la fusion de lysosomes (Calcium release through P2X4 activates calmodulin to promote endolysosomal membrane fusion 2015).
Ce double rôle du Ca++, fission par TRMPL1 et fusion, pourrait être subordonné aux gradients de pH des microdomaines de la membrane lysosomale.
- Une forte concentration en H+ favoriserait la fission via TRPML1.
- Une faible concentration en H+, par réduction de l'activité de la V-ATPase, favoriserait la fusion via P2X4.
2. Les canaux Ca++ voltage-dépendants de type P/Q (Cav2.1) sont localisés sur la membrane plasmique des cellules excitables.
Or, on en a retrouvé sur la membrane des lysosomes neuronaux, pouvant jouer un rôle dans la fusion autophagosome-lysosome (A Voltage-Gated Calcium Channel Regulates Lysosomal Fusion with Endosomes and Autophagosomes and Is Required for Neuronal Homeostasis 2015).
3. TRPA1, canal cationique non sélectif perméable au Ca++, exprimé principalement sur les nocicepteurs afférents primaires, a été retrouvé dans les lysosomes périphériques des neurones du ganglion de la racine dorsale (DRG) (Intracellular TRPA1 mediates Ca2+ release from lysosomes in dorsal root ganglion neurons 2016).
- L'efflux lysosomal de Ca++ via TRPA1 peut déclencher l'exocytose des vésicules et la libération de neuropeptides (NPY, CGRP).
- Le canal TRPA1 intracellulaire pourrait intervenir dans la sensation nociceptive.
Recharge en calcium des lysosomes
La capacité de stockage des réserves intracellulaires étant limitée, la libération de Ca++ des réserves doit être suivie d'une recharge (refilling en anglais) en Ca++.
- La recharge en Ca++ du réticulum endoplasmique (RE) est dépendante du processus SOCE (Store-Operated Calcium Entry) dont le mécanisme moléculaire a été décrit (Calcium signalling remodelling and disease 2012).
- Toutefois, les mécanismes de recharge des réserves lysosomales sont largement inconnus.
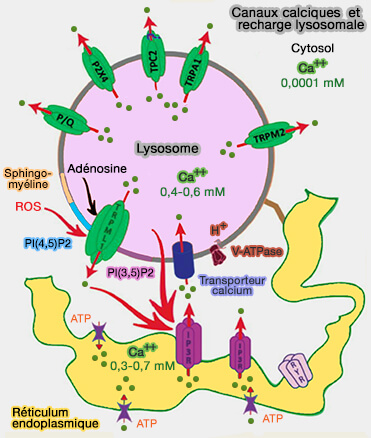
(Figure : vetopsy.fr d'après Feng et Yang)
1. Un premier modèle suggère que la recharge calcique lysosomale est un processus dépendant du pH (Molecular mechanisms of endolysosomal Ca2+ signalling in health and disease 2011).
- L'augmentation du pH lysosomal, soit par les inhibiteurs de la V-ATPase, soit par des réactifs alcalinisants tels que NH4Cl, entraîne la perte des réserves lysosomales de Ca++.
- Dans les vacuoles des levures et des plantes, les équivalents lysosomes de ces organismes, l'échangeur Ca++/H+ est requis pour le maintien de leur réserve de Ca++.
2. Un deuxième modèle, plus récent, a mis en évidence le rôle du réticulum endoplasmique (The endoplasmic reticulum, not the pH gradient, drives calcium refilling of lysosomes 2016 et Calcium signaling at ER membrane contact sites 2016).
- L'épuisement des réserves de Ca++ du réticulum endoplasmique a aboli le remplissage.
- L'inhibition des récepteurs inositol triphosphate (IP3R) a provoqué un dysfonctionnement des lysosomes et un phénotype de type LSD (
IP3R et calcium).
- La localisation spatiale du réticulum endoplasmique et des lysosomes est en faveur du rôle critique du réticulum endoplasmique (High resolution structural evidence suggests the Sarcoplasmic Reticulum forms microdomains with Acidic Stores (lysosomes) in the heart 2017 et An Endosomal NAADP-Sensitive Two-Pore Ca2+ Channel Regulates ER-Endosome Membrane Contact Sites to Control Growth Factor Signaling 2017).
Retour à les lysosomes
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


