Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
7. Déshabillage de la vésicule
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

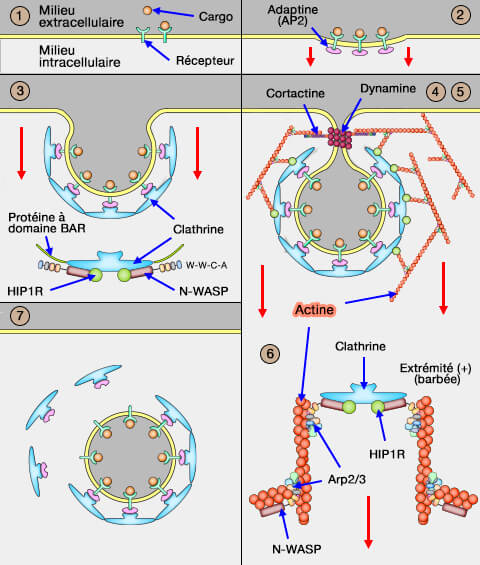
Dans l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis), la vésicule est déshabillée, i.e. perd son manteau de clathrine, pour pouvoir être absorbée par les endosomes.
(Figure : vetopsy.fr)
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
7. Le déshabillage de la vésicule (uncoating) via des facteurs cytosoliques est une étape indispensable au trafic des vésicules, car le manteau gêne l’interaction avec les endosomes précoces.
a. Ce déshabillage nécessite :
- Hsc70/HSPA8 (70 kDa), protéine appartenant à la famille des protéines de choc thermique et des protéines chaperons(The human HSP70 family of chaperones: where do we stand? 2016),
- l'auxiline/GAK, qui représente un membre des co-chaperons de Hsc70 (A sequential mechanism for clathrin cage disassembly by 70-kDa heat-shock cognate protein (Hsc70) and auxilin 2011).
b. L'assemblage est relativement stable alors que le démontage est très rapide, i.e. le cycle complet ne dure que 30 à 60 secondes.
L'habillage de la vésicule sera ensuite recyclé.
Vue d'ensemble du déshabillage de la vésicule de clathrine
Généralités
1. Quand la vésicule est entièrement internalisée, elle perd rapidement son revêtement de clathrine, i.e. en quelques secondes, pour pouvoir fusionner plus facilement avec les endosomes précoces.
a. Malgré l'intrication des triskélions, le démontage est très rapide.
- La seule rotation d'un triskélion autour de son axe peut le désolidariser du manteau.
- Sa forme lui permet de ne pas interférer avec ceux qui demeurent dans la structure.
b. In vivo, ce processus commence dans les 5 secondes suivant le détachement de la membrane et le cycle complet ne dure que 30 à 60 secondes.

La cage de clathrine ne semble pas être complètement " achevée ", en particulier au niveau du cou, ce qui facilite le processus de déshabillage.

(Figure : vetopsy.fr d'après Xing)
2. Ce déshabillage nécessite tout d'abord Hsc70/HSPA8, ATPase qui va fournir l'énergie pour le déshabillage (
3. Pour déshabiller la cage de clathrine, Hsc70 doit être recrutée par des co-chaperons de deux types.
a. Des protéines à domaine J (JDP), comme l'auxiline/GAK, stimulent l'hydrolyse de l'ATP par Hsc70 et contiennent des sites de liaison aux substrats concernés.
b. Des facteurs d'échange de nucléotides (NEF), dont le rôle est identique aux GEF (Guanine nucleotide exchange factor), favorisent le remplacement de l'ADP lié à l'Hsc70 par l'ATP (The nucleotide exchange factors of Hsp70 molecular chaperones 2015).
Les bactéries et les organites d'origine bactérienne ont un seul type connu de NEF pour Hsp70, le GrpE bactérien, alors que, pour les cellules eucaryotes, un grand nombre de NEF, appartenant aux familles de protéines de domaine Hsp110/Grp170, HspBP1/Sil1 et BAG, ont été découvertes.

Hsc70/HSPA8 et l'auxiline/GAK sont étudiées dans des chapitres spéciaux.
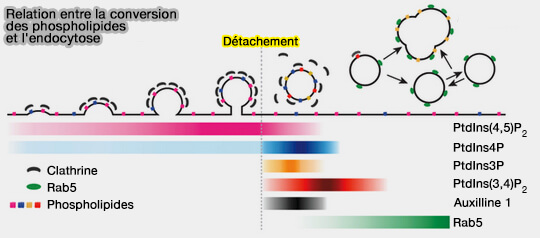
Et les phospholipides ?
La composition en phosphoinositides d'une vésicule d'endocytose reste inchangée, malgré une augmentation de PI(3,4)P2 au début de sa formation, jusqu'au moment de la séparation de la membrane plasmique.
(Figure : vetopsy.fr d'après He et coll)
Une série programmée de conversions de phosphoinositides accompagne les différentes étapes du cycle d'assemblage-désassemblage de clathrine dans le trafic membranaire endocytaire (Dynamics of phosphoinositide conversion in clathrin-mediated endocytic traffic 2017 et Dynamics of Auxilin 1 and GAK in clathrin-mediated traffic 2020).
- Ces conversions, avec des demi-temps de 1 à 5 s, dépendent de la fermeture de la vésicule et leur apparition crée un signal moléculaire indiquant que la scission est terminée.
- Une cascade de dépendances conduit à d'autres signaux moléculaires, dont l'accumulation de PI(3,4)P2 qui annoncerait le déshabillage et entraînerait l'arrivée de la petite GTPase Rab5, régulateur principal de la dynamique des endosomes précoces.
Mécanisme du déshabillage

(Figure : vetopsy.fr d'après Mechanobiology institute de Singapour)
L'auxiline se lie à l'intérieur de la jambe de la chaîne lourde de la clathrine, le domaine J tourné vers le sommet.
- Le domaine J recrute l'Hsc70.
- L'Hsc70 se lie par la fente du domaine SBD, " couvercle ouvert " par l'hydrolyse de l'ATP, au motif QLMLT des domaines C-terminaux des chaînes lourdes de clathrine pour déstabiliser le manteau (Structure of clathrin coat with bound Hsc70 and auxilin: mechanism of Hsc70-facilitated disassembly 2009).

(Figure : vetopsy.fr d'après Sousa et coll)
1. La liaison du complexe auxiline/Hsc70 au motif QLMLT du triskélion " déplace " les chevilles de deux autres triskélions (Single-molecule analysis of a molecular disassemblase reveals the mechanism of Hsc70-driven clathrin uncoating 2011).
- Ces chevilles sont connectées aux jambes qui sont essentielles à l'assemblage du manteau de clathrine, ce qui déstabilisera l'ensemble pour éjecter le triskélion.
- Le mécanisme exact est encore en cours d'étude.

(Figure : vetopsy.fr d'après Xing)
2. Le triskélion est encore lié au Hsc70 pour qu'une agrégation aberrante de clathrine ne forme pas de cage dans le cytosol (The role of molecular chaperones in clathrin mediated vesicular trafficking 2015).
- Cette séquestration doit être régulée de telle manière que la clathrine soit libérée et disponible pour un nouveau cycle d'endocytose.
- L'auxiline est recyclée (Multiple Roles of Auxilin and Hsc70 in Clathrin-Mediated Endocytosis 2007).
3. La dissociation de la clathrine de Hsc70 est contrôlée probablement par les NEF (Nucleotide Exchange Factors).
- Le NEF provoque la libération de l'ADP de Hsc70 qui formait un complexe très stable avec la clathrine.
- Ce NEF est probablement Hsp110 de la même famille que Hsp70 (Unique Peptide Substrate Binding Properties of 110-kDa Heat-shock Protein (Hsp110) Determine Its Distinct Chaperone Activity 2011).
4. Un nouvel ATP peut alors se lier au complexe Hsc70/clathrine pour le dissocier.
8. Incorporation dans les endosomes précoces
La vésicule déshabillée continue son périple pour rejoindre les endosomes précoces desquels elle peut rebourgeonner.

Les endosomes précoces sont étudiés dans un chapitre spécial avec le système endomembranaire.
Retour à l'endocytose
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


