Enzymes
Groupe des
transférases (EC 2)
Lipides kinases
Phosphatidylinositol Kinases (PI-kinases)
Phosphatidylinositol phosphates kinases : PIPK
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Vitamines
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les phosphatidylinositol phosphates kinases (PIPK) sont une famille de kinases, phosphatidylinositol kinases (PIK ou PI-Kinases) capables de phosphoryler le groupe hydroxyle en position 4 ou en position 5 du cycle inositol des phosphoinositides.
Vue d'ensemble des PIPK
Les PIPK produisent :
- du PI(4,5)P2 ou PIP2 :
- par la phosphorylation de PI(4)P par la classe I (PIPKI),
- par la phosphorylation de PI(5)P par la classe II (PIPKII) ;
- du P(3,5)P2 par la phosphorylation de PI(3)P pour la classe III (PIPKIII), PIKfyve des mammifères.
PI(4,5)P2 ou PIP2 est une molécule essentielle qui régule divers processus cellulaires tels que (Review of PIP2 in Cellular Signaling, Functions and Diseases 2020) :
- la signalisation des récepteurs couplés aux protéines G (GPCR), des canaux ioniques et des transporteurs,
- le trafic vésiculaire,
- la chimiotaxie et le mouvement cellulaire.
p2.jpg)
(Figure : vetopsy.fr)
Les phosphatidylinositol phosphates kinases (PIPK) comprennent deux classes :
- les PIPKI, PI4P5K ou 1-phosphatidylinositol-4-phosphate 5-kinases, qui forment la voie principale, phosphorylent PI(4)P sur le groupe hydroxyle en position 5 du cycle inositol,
- les PIPKII, PI5P4K ou 1-phosphatidylinositol-5-phosphate 4-kinases, phosphorylent PI(5)P sur le groupe hydroxyle en position 4 du cycle inositol,
Les PIPKIII, comme PIKfyve, sont classés dans cette famille car il peut phosphoryler PI(3)Pen PI(3,5)P2, en plus de phosphoryler le phosphatidylinositol (PtdIns) en PI(5)P .
PIPKI ou PI4P5K

La voie principale pour produire du PI(4,5)P2 ou PIP2, et donc PI(3,4,5)P3 ou PIP3 , dépend de la phosphorylation de PI(4)P par les PIPKI, d'où le nom de 1-phosphatidylinositol-4-phosphate 5-kinases.
$\ce{ATP + PI(4)P}$ $\leftrightharpoons$ $\ce{ADP + PI(4,5)P2}$
Vue d'ensemble
1. Les PIPK de type I (EC 2.7.1.68), homologues de Mss4p de la levure, formés d'environ 540 résidus, se présentent sous la forme de trois homologues (Phosphatidylinositol-4,5-bisphosphate: Targeted Production and Signaling 2013) :
- PIPKIα ou PI4P5Kα (PIP5K1A),
- PIPKIβ ou PI4P5Kβ (PIP5K1B),
- PIPKIγ ou PI4P5Kγ (PIP5K1C).
p2-roles.jpg)
(Figure : vetopsy.fr d'après Burke)
En outre, PIPKIγ comporte plusieurs variants d'épissage (γ1 à γ6 chez l'homme) qui en fait un régulateur essentiel de l'assemblage et du désassemblage (Two novel phosphatidylinositol-4-phosphate 5-kinase type Iγ splice variants expressed in human cells display distinctive cellular targeting 2009) :
- des adhérences focales, i.e. sites d'interaction cellule/matrice,
- des jonctions adhérentes, i.e. site d'interactions cellule/cellule.
2. Les PIPKI peuvent se dimériser.
Dans les cellules humaines, le PIP5Kβ de type I forme des homo- et hétéro-dimères avec le PIP5Kγ qui semblent essentiels pour l'activité enzymatique et la localisation aux membranes plasmiques (Resolution of structure of PIP5K1A reveals molecular mechanism for its regulation by dimerization and dishevelled 2015).
Structure des PIPK
Les structures des PIPKI et PIPKII sont globalement similaires.
1. On trouve un domaine de dimérisation et un domaine kinase lipidique.
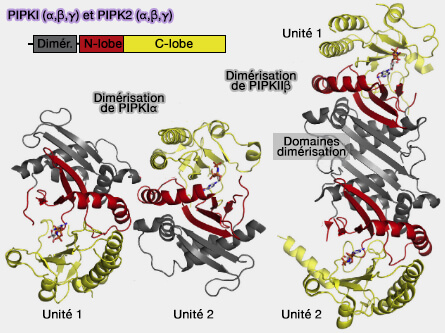
(Figure : vetopsy.fr d'après Burke)
La dimérisation est différente selon les PIPK.
- Les PIPKII dimérisent via leur domaine de dimérisation sans aucun rôle du domaine kinase.
- Les PIPKI dimérisent à l'interface des deux domaines, ce qui pourrait modifier l'interaction avec les protéines de liaison (Resolution of structure of PIP5K1A reveals molecular mechanism for its regulation by dimerization and dishevelled 2015).
2. Les régions N- et C-terminales sont variables pour réguler des fonctions spécifiques.
Activation et interactions
1. Les PI4P5k peuvent être activées en aval par certain nombre de partenaires de liaison comme les petites GTPases RHOA/RAC1 et ARF6.
2. Certaines interactions sont régulées par les régions variables des isoformes.
Par exemple, les PIPKIγ possèdent des extrémités C-terminales différentes selon ses variants (PIP5K-driven PtdIns(4,5)P2 synthesis: regulation and cellular functions 2009).
- PI4P5KG-668 est seul capable de se lier à l'adaptateur AP-2 de la clathrine, i.e. aux sous-unités μ2 et β2 de AP-2 révélant la base moléculaire de cette spécificité (Molecular Basis for Association of PIPKIγ-p90 with Clathrin Adaptor AP-2 2010).
- PI4P5KA peut être directement activé par la signalisation Wnt, via le domaine DIX de la protéine dishevelled (Resolution of structure of PIP5K1A reveals molecular mechanism for its regulation by dimerization and dishevelled 2015).
PIPKII ou PI5P4K
La voie secondaire pour produire du PI(4,5)P2 ou PIP2, et donc PI(3,4,5)P3 ou PIP3, dépend de la phosphorylation de PI(5)P par les PIPKII, d'où le nom de 1-phosphatidylinositol-5-phosphate 4-kinases.
$\ce{ATP + PI(5)P}$ $\leftrightharpoons$ $\ce{ADP + PI(4,5)P2}$
Comme la concentration en PI(5)P est très faible, les PIPK de type II ne peuvent agir que :
- pour réduire la concentration de PI(5)P,
-

PIPK : structure et dimérisation
(Figure : vetopsy.fr d'après Burke)

Vous pouvez lire : Exploring phosphatidylinositol 5-phosphate 4-kinase function (2015).
Vue d'ensemble
1. Les PIPK de type II (EC 2.7.1.149), formés d'environ 420 résidus, possèdent, comme les PIPK de classe I, trois isoformes (Evolutionarily conserved structural changes in phosphatidylinositol 5-phosphate 4-kinase (PI5P4K) isoforms are responsible for differences in enzyme activity and localization 2013) :
- PIPKIIα ou PI5P4Kα (PIP4K2A),
- PIPKIIβ ou PI5P4Kβ (PIP4K2B),
- PIPKIIγ ou PI5P4Kγ (PIP4K2C).
| Signal biologique | GTP | ATP/AMP |
|---|---|---|
| Capteur | PIPKIIβ | AMPK |
| Signalisation | Messagers lipidiques | Phosphorylations protéiniques |
| Effets | Changements métaboliques Contrôle croissance |
|
2. La structure des PIPK de type II est étudiée dans les PIPK de type I.
Activation et
interactions
1. Les activités des PIPKII sont plus ou moins fortes.
- D'une part, elle diminuent du α ou γ si bien que certains se sont demandés si PIPKIIγ avait une quelconque activité.
Cependant, dans sa localisation vésiculaire, exposé peut-être à un pool local de PI(5)P avec des niveaux millimolaires d'ATP pour le conduire à un taux maximum, il peut avoir une activité suffisante pour avoir un impact sur les niveaux locaux de PI(5)P ou PI(4,5)P2 ou PIP2.
- D'autre part, les PIPKII peuvent se dimériser entre elles, ce qui pourrait affecter leur activité.
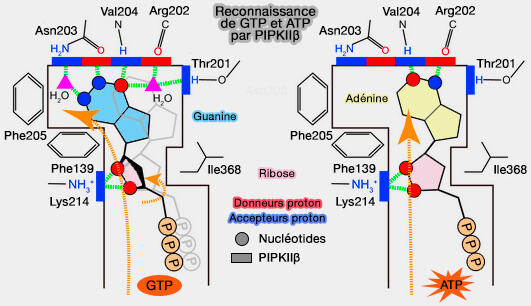
(Figure : vetopsy.fr d'après Sumita et coll)
2. PIPKIIβ utilise préférentiellement le GTP au lieu de l'ATP en tant que donneur de phosphate, faisant penser qu'il agit comme détecteur de GTP dans les cellules, et a un rôle majeur dans (The Lipid Kinase PI5P4Kβ Is an Intracellular GTP Sensor for Metabolism and Tumorigenesis 2016) :
- le métabolisme,
- la cancérogenèse.
PIPKIII (PIKfyve)
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesProtéines kinasesLipides kinasesHydrolasesPeptidases/protéasesPhosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


