Système endo-lysosomal
Endosomes tardifs
Complexe HOPS
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

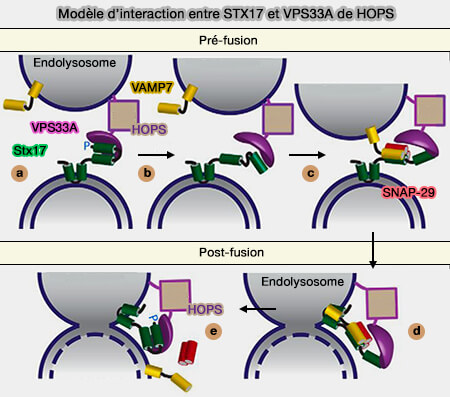
Le complexe d’attache HOPS (Homotypic fusion and vacuole Protein Sorting), interagit avec Rab7 dans les endodomes tardifs pour reconnaître ses partenaires et soutenir la fusion membranaire.

(Figure : vetopsy.fr d'après Spang)
La maturation des endosomes précoces et la fusion des endosomes tardifs nécessitent :
- des lipides spécifiques, en particulier PI(3,5)P2 et LBPA/BMP (
phospholipides et endosomes),
- la petite GTPase Rab7 (Ypt7 de la levure),
- le complexe HOPS,
- les protéines SNARE.
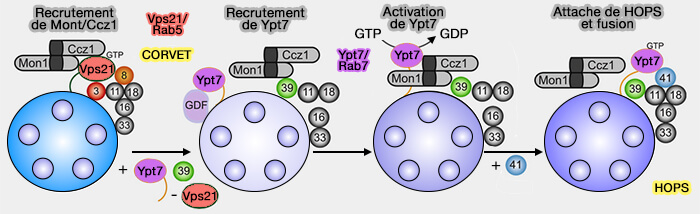
(Figure : vetopsy.fr d'après Nordmann et coll)
Complexe HOPS
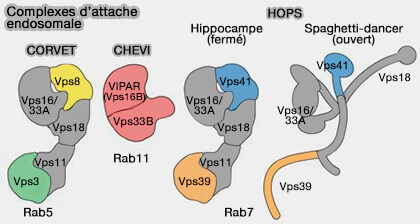
(Figure : vetopsy.fr d'après van der Beck et coll)
Rab7 interagit avec le complexe d’attache HOPS (Homotypic fusion and vacuole Protein Sorting), dont le rôle est de (Membrane Tethering Complexes in the Endosomal System 2016) :
- reconnaître les partenaires de Rab7, via Vps39 et Vps41,
- soutenir la fusion membranaire via Vps33, une protéine de la famille des protéines SM ou Sec1/Munc1 (HOPS catalyzes the interdependent assembly of each vacuolar SNARE into a SNARE complex 2017).
(Figure : vetopsy.fr d'après Baker et Hugson)
HOPS de la levure
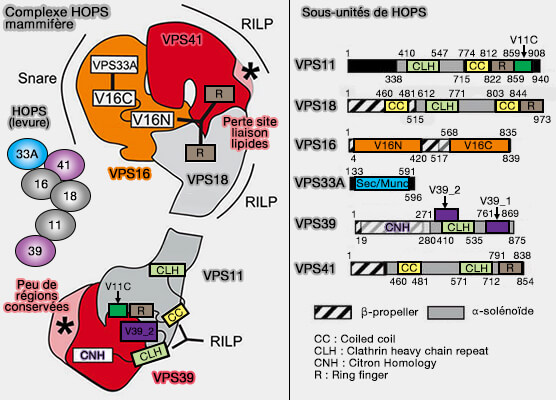
Le complexe HOPS, initialement identifié chez la levure au départ pour sa fonction de promotion de la fusion homotypique des vacuoles dans le cadre de leur cycle héréditaire, est un complexe d'attache qui se compose de six sous-unités (Molecular architecture of the multisubunit homotypic fusion and vacuole protein sorting (HOPS) tethering complex 2012 et Characterization of the Mammalian CORVET and HOPS Complexes and Their Modular Restructuring for Endosome Specificity 2015) :
- Vps11, Vps16, Vps18 et Vps33 de la famille des protéines SM ou Sec1/Munc18, communes avec le complexe CORVET,
- Vps39 et Vps41 interagissant avec Rab7 (Vps3 et Vps8 interagissant avec Rab5 pour CORVET).
Vps39 et Vps41
Vps39
1. Vps39 et Vps41 interagissent avec Ypt7 de la levure (Rab7) et fournissent ainsi le lien vers l'organite avec lequel la fusion doit être initiée, i.e. endosomes tardifs, phagosomes, autophagosomes et lysosomes (The HOPS Proteins hVps41 and hVps39 Are Required for Homotypic and Heterotypic Late Endosome Fusion 2013).
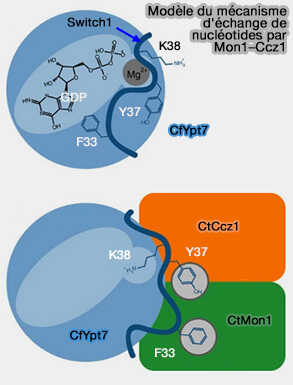
de nucléotides par Mon-Ccz1
(Figure : vetopsy.fr d'après
Naslavsky et Caplan)
- Vps39 et Vps41 sont chacun en contact avec l'un des deux partenaires de fusion (The HOPS/class C Vps complex tethers membranes by binding to one Rab GTPase in each apposed membrane 2015).
- Seul, Vps41 interagit avec les lipides (Phosphorylation of a membrane curvature–sensing motif switches function of the HOPS subunit Vps41 in membrane tethering 2010).
2. Vps39 lié au HOPS avait initialement été proposé pour agir comme échangeur de guanine pour Rab7, i.e. comme GEF (
- Toutefois, le complexe Mon1-Ccz1 s'est avéré avoir une activité GEF pour Rab7.
- Il a été suggéré que HOPS pourrait agir comme recruteur potentiel du GEF par liaison directe avec le GEF (The Mon1-Ccz1 Complex Is the GEF of the Late Endosomal Rab7 Homolog Ypt7 2010 et Architecture and mechanism of the late endosomal Rab7-like Ypt7 guanine nucleotide exchange factor complex Mon1–Ccz1 2017).
Remarque : dans les cellules cancéreuses du sein exprimant des niveaux accrus de Rab2a, Vps39 se lie également à Rab2a-GTP présent sur les compartiments endosomaux qui libèrent des métalloprotéinases matricielles (MPP), comme MT1-MMP (Membrane Type 1P-Matrix Metalloprotease), des invadopodes (RAB2A controls MT1-MMP endocytic and E-cadherin polarized Golgi trafficking to promote invasive breast cancer programs 2016).
L'identité précise de ce compartiment fait encore l'objet d'investigations (Harnessing membrane trafficking to promote cancer spreading and invasion: The case of RAB2A 2018).
3. Vps39 est aussi utilisé avec TOM40 pour former des vCLAMP (vacuolar and mitochondrial patch), i.e. sites de contact membranaire vacuole/mitochondrie.
Vps41
3. Vps41 a été localisée dans de petites vésicules de transport provenant du trans-golgi (TGN).
a. Ces vésicules contiennent les protéines membranaires lysosomales intégrales LAMP-1 et LAMP-2, mais pas le récepteur du mannose 6-phosphate (MPR), le principal récepteur de transport des enzymes lysosomales (hVps41 and VAMP7 function in direct TGN to late endosome transport of lysosomal membrane proteins 2013).
| Interactions | VIPAS39/ VPS33B |
VPS8 | VPS11 | VPS16 | VPS33A |
|---|---|---|---|---|---|
| VIPAS39/ VPS33B |
Oui | Non | Non | Non | Non |
| TGFBRAP1 VPS3 |
Non | Oui | Oui | Non | Oui |
| VPS8 | Non | Oui | Oui | Non | - |
| VPS11 | Non | Oui | Oui | Oui | Oui |
| VPS16 | Non | Oui | Oui | Oui | Oui |
| VPS33A | Non | - | Oui | - | Oui |
b. Le KO de Vps41 entraîne :
- l'accumulation de porteurs de LAMP, indiquant un défaut de leur fusion avec les endosomes tardifs ou des lysosomes,
- une altération du transport de la PAL (phosphatase alcaline) lysosomale qui nécessite une interaction de Vps41 avec le complexe de protéine adaptatrice hétérotétramère AP-3. (Self-Assembly of VPS41 Promotes Sorting Required for Biogenesis of the Regulated Secretory Pathway 2013).
Autres sous-unités
1. VPS18 se lie avec :
- VPS41 via leurs domaines RING (VPS18 recruits VPS41 to the human HOPS complex via a RING-RING interaction 2017),
- VPS33A/VPS16.
Remarque : VPS8 de CORVET, qui possède une structure identique à VPS41, mais plus longue et qui se finit par une région désordonnée, ne peut se lier à à VPS18.
(Figure : vetopsy.fr d'après Saleeb et coll)
2. VPS11 est le récepteur central pour les sous-unités spécifiques à HOPS et CORVET (
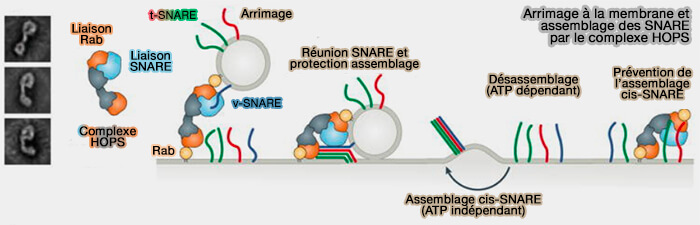
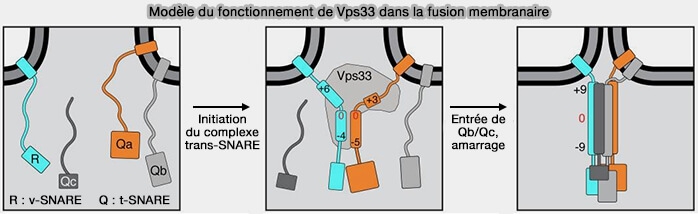
3. Vps33, et potentiellement d'autres protéines SM (Recruitment of VPS33A to HOPS by VPS16 Is Required for Lysosome Fusion with Endosomes and Autophagosomes 2015) :
- catalyse l'assemblage du complexe SNARE grâce à la reconnaissance de protéines t-SNARE (t pour target, cible) spécifiques pour générer des intermédiaires d'assemblage SNARE partiellement zippés (A direct role for the Sec1-Munc18-family protein Vps33 as a template for SNARE assembly 2016),
- veille à ce que seul l'assemblage SNARE correct soit autorisé à procéder à la promotion de la fusion membranaire.
Le complexe SNARE impliqué est composé de (Sec1/Munc18 protein Vps33 binds to SNARE domains and the quaternary SNARE complex 2012) :
- Q-SNARE (t-SNARE), i.e. Qa-SNARE ou syntaxine 7 (STX7), Qb-SNARE ou Vti1b, Qc-SNARE ou syntaxine 8 (STX8),
- R-SNARE (v-SNARE), i.e. VAMP8 ou VAMP7.

La fusion vésiculaire est traitée, plus en détail, avec les protéines SNARE, en particulier dans VAMP7 et autophagie.
(Figure : vetopsy.fr d'après Baker)
4. Le complexe HOPS peut se présenter sous deux formes.
-

Complexes d'attache endosomale
(Figure : vetopsy.fr d'après van der Beck et coll) - La configuration dite " spaghetti-danseur " montre une structure bien plus étendue qui pourrait représenter HOPS dans une conformation ouverte, qui se ferme en fonction de son cyle de réactions (CATCHR and HOPS-CORVET tethering complexes share a similar architecture 2016).
HOPS des mammifères
Le complexe HOPS des mammifères, qui contient 6 sous-unités homologues à celles de la levure, fonctionne globalement de la même manière avec deux différences majeures.
(Figure : vetopsy.fr d'après van der Kant et coll)
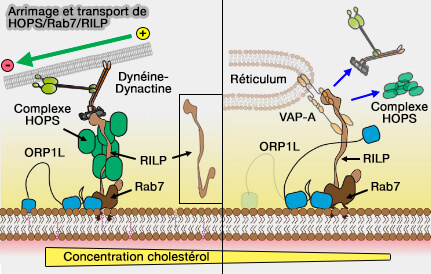
1. Contrairement à la levure, le complexe HOPS des mammifères n'est pas recruté dans les membranes par Rab7, mais par liaison à l'effecteur RILP (RAB7 interacting lysosomal protein) qui n'a pas d'orthologue apparent chez la levure (Late endosomal transport and tethering are coupled processes controlled by RILP and the cholesterol sensor ORP1L 2013).
Cette interaction met en jeu Vps39 qui peut aussi se lier à PLEKHM1.
La tête et la queue du complexe HOPS des mammifères peuvent se lier à l'homodimère Rab7-RILP sous deux conformations :
-
Attache et transport de HOPS/Rab7/RILP par la dynéine
(Figure : vetopsy.fr d'après van der Kant et coll) - une conformation active dans laquelle RILP-HOPS contacte des protéines d'autres vésicules (endosomes tardifs, phagosomes ou autophagosomes).
Remarque : RILP par sa liaison avec le complexe dynéine/dynactine, joue un rôle majeur dans le transport rétrograde des endosomes tardifs/lysosomes.
2. En effet, Vps41 mammalien semble-t-il, ne contient pas de sites de liaison aux lipides et doit passer par une RILP (RILP interacts with HOPS complex via VPS41 subunit to regulate endocytic trafficking 2014).
- RILP pourrait agir comme une protéine d'échafaudage ou stabiliserait les interactions au sein du complexe HOPS.
- Le passage de RAB7 à la liaison à l'effecteur RAB7 RILP reflète peut-être une régulation d'ordre supérieur telle que la liaison concomitante du complexe moteur régulé par la dynéine.
Remarque : Vps41 est aussi recruté sur les lysosomes via la petite GTPase Arl8b (The small GTPase Arl8b regulates assembly of the mammalian HOPS complex on lysosomes 2015).
3. Rab7-RILP lie simultanément le complexe HOPS et le complexe moteur à base de dynéine (
Retour aux endosomes tardifs
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaire Moteurs moléculairesVoies de signalisation


