Fusion membranaire : protéines SNARE
Protéines R-SNARE : VAMP
VAMP7
: structure et activation
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

VAMP7 (également appelé VAMP insensible à la neurotoxine tétanique, TI-VAMP, Tetanus neurotoxin Insensitive-VAMP ou SYBL1, Synaptobrevin-like protein 1), R-SNARE contenant une arginine (R) dans la couche 0 du motif SNARE, est une v-SNARE (v pour vésiculaire) impliquée dans la fusion vésiculaire, en particulier des lysosomes.
Vue d'ensemble de VAMP7
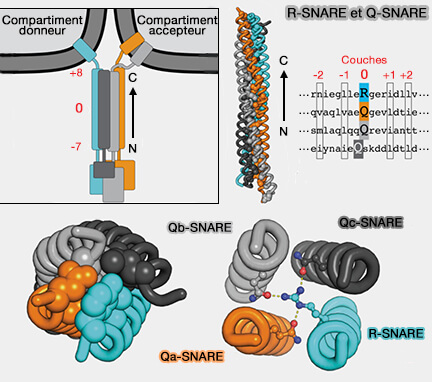
(Figure : vetopsy.fr d'après Baker et coll)
VAMP7 (également appelé VAMP insensible à la neurotoxine tétanique, TI-VAMP, Tetanus neurotoxin Insensitive-VAMP ou SYBL1, Synaptobrevin-like protein 1) est impliquée dans la fusion des vésicules :
- dérivées, en général, des endosomes tardifs et des lysosomes,
- mais aussi de l'appareil de Golgi.
Elle joue ainsi un rôle dans diverses fonctions cellulaires :
- phagocytose, mitose, migration cellulaire,
- réparation et croissance des membranes, croissance des neurites lors du développement neuronal,
- biosynthèse des autophagosomes,
- dégradation des cargos via la fusion autophagosomes/lysosomes,
- exocytose lysosomale et autophagosomale.
Structure de VAMP7
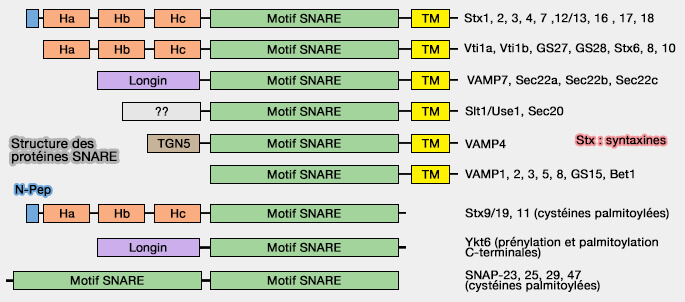
(Figure : vetopsy.fr d'après Hong et Lev)
1. VAMP7, dont la principale isoforme est VAMP7A, comprend :
- un domaine longin, motif coiled-coil N-terminal,
- un domaine SNARE,
- un domaine transmembranaire (TM ou TMD) C-terminal.
La famille des protéines SNARE à domaine longin comprend aussi YKT6 et SEC22B (Structure and function of longin SNAREs 2015).
Ce domaine est un domaine régulateur important pour la fusion du complexe trans-SNARE et donc la fusion membranaire (
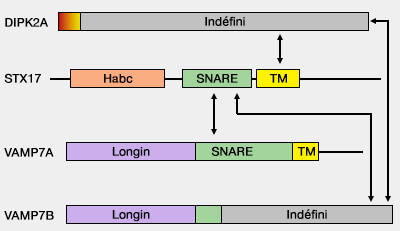
(Figure : vetopsy.fr d'après Tian et coll)
2. Une isoforme de VAMP7A, VAMP7B, dépourvue du domaine longin, peut inhiber la fusion autophagosome-lysosome en améliorant l'interaction de VAMP7A et STX17 (DIPK2A promotes STX17- and VAMP7-mediated autophagosome-lysosome fusion by binding to VAMP7B 2020).
- VAMP7B se lie au domaine SNARE de STX17 de manière compétitive avec VAMP7A via son domaine C terminal.
- DIPK2A (DIvergent Protein Kinase domain 2A), une protéine localisée dans les lysosomes, perturbe leur interaction.
DIPK2A favorise la fusion autophagosome/lysosome en améliorant l'interaction STX17-VAMP7A.
Activation de VAMP7
1. VAMP7 adopte une conformation majoritairement fermée en solution, qui ne nécessite a priori aucun régulateur contrairement à Ykt6, ce qui lui permet son déplacement au sein de la cellule.
Le domaine longin interagit avec le propre domaine SNARE de VAMP7 pour auto-inhiber la protéine elle-même (The Longin SNARE VAMP7/TI-VAMP Adopts a Closed Conformation 2010).
- La stabilisation de cette structure fermée nécessite au moins les résidus 126 à 160 du domaine SNARE.
- Les résidus leucine 43 et tyrosine 45 du domaine longin sont essentiels à cette interaction.
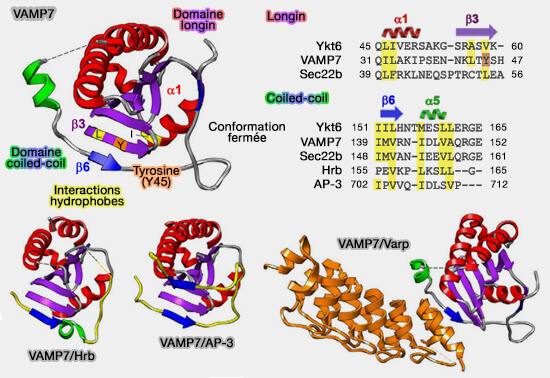
(Figure : vetopsy.fr d'après Daste et coll)
2. La phosphorylation de la tyrosine 45 (Y45) de β3 provoque la transition de sa position fermée à la position ouverte (Increased activity of the Vesicular Soluble N-Ethylmaleimide-sensitive Factor Attachment Protein Receptor TI-VAMP/VAMP7 by Tyrosine Phosphorylation in the Longin Domain 2013).
Toutefois, la configuration fermée de VAMP7 n'empêche pas la formation du complexe trans-SNARE mais la retarde seulement, car VAMP7 peut encore interagir in vitro avec ses partenaires de la membrane plasmique t-SNARE, i.e. la syntaxine 1A et SNAP-25, bien que dans une moindre mesure que VAMP7 sans domaine longin.
3. L'inhibition de l'assemblage du complexe SNARE est renforcée par la liaison à Varp (Vps9- ankyrin repeat protein), un GEF et un effecteur de la petite GTPase Rab21 (The binding of Varp to VAMP7 traps VAMP7 in a closed, fusogenically inactive conformation 2012).
Varp, par un domaine C-terminal riche en répétitions d'ankyrine, se lie à la conformation fermée de VAMP7 et la stabilise en interagissant simultanément avec les domaines longin et SNARE et les domaines coiled-coil (
Rôles de VAMP7
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


