Système endo-lysosomal
Complexe ESCRT
ESCRT-III et Vps4
Modèle de remodelage membranaire et scission
- Vue d'ensemble du système endomembranaire
- Endosomes
- Vue d'ensemble des endosomes
- Endosomes précoces
- Endosomes de recyclage
- Vésicules intraluminales (ILV) et endosomes ou corps mutivésiculaires (MVE/MVB)
- Endosomes tardifs
- Système endo-lysosomal et phosphoinositides
- MCS (sites de contact membranaire) RE/endosomes/lysosomes
- Lysosomes
- Trafic des endosomes/lysosomes
- Fusion et fission membranaire
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

L'extrémité C-terminale de ESCRT-III recrute plusieurs molécules effectrices dont la protéine VPS4 (AAA ATPase vacuolaire de tri 4) qui a un rôle essentiel dans le contrôle actif de la constriction du cou et de la fission de la vésicule.
Le complexe ESCRT (Endosomal Sorting Complex Required for Transport ou complexe de tri endosomal requis pour le transport) est composé de 5 complexes :
- ESCRT-0,
- ESCRT-I,
- ESCRT-II,
- ESCRT-III,
- Vps4 (Vacuolar Protein Sorting 4) qui contient un domaine catalytique AAA+ ATPase.
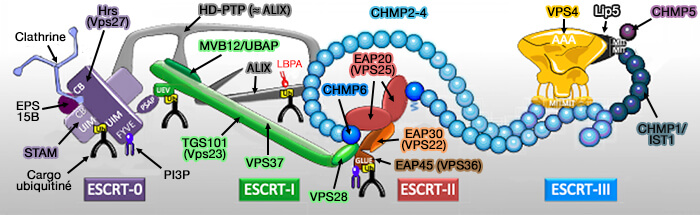
(Figure : vetopsy.fr d'après Christ et Hill)
L'extrémité C-terminale de ESCRT-III recrute plusieurs molécules effectrices dont la protéine VPS4 (AAA ATPase vacuolaire de tri 4) qui a un rôle essentiel dans :
- le désassemblage et le recyclage de l'ESCRT-III, i.e. formes solubles des CHMP,
- le contrôle actif de la constriction du cou et de la scission de la vésicule (The ESCRT machinery: From the plasma membrane to endosomes and back again 2015).

Les principes de l'activité d'ESCRT-III sont un assemblage et un désassemblage séquentiels de sous-unités (séquences de polymérisation) pilotés par l'ATP, via Vps4, qui induit des changements dans les propriétés du polymère ESCRT-III pour déclencher deux étapes de transitions de forme :
- le flambement filamentaire, favorisant la déformation de la membrane,
- la constriction filamentaire, favorisant la fission membranaire.
Modèles de remodelage membranaire et fission
1. Les modèles dépendent des voies considérées, car les ESCRT peuvent intervenir sur plusieurs processus.
- Dans la biogenèse des endosomes ou corps multivésiculaires (MVE/MVB), les ESCRT favorisent à la fois le bourgeonnement et la scission.
- Lors de la cytokinèse, les ESCRT semblent être impliquées dans le rétrécissement massif du col cytokinétique de 1,5 µm à zéro.
2. Les modèles suivants ont été repris de l'excellent article : Reverse-topology membrane scission by the ESCRT complexes (2017) et renvoient à des vidéos pour une meilleure compréhension.
a. Ils reprennent le bourgeonnement viral par le complexe ESCRT-III.
- De nombreux virus enveloppés utilisent tout ou partie de la machinerie ESCRT pour compléter leur cycle (Mechanisms for enveloped virus budding: Can some viruses do without an ESCRT? 2008 et Virus Budding and the ESCRT Pathway 2013).
C'est le cas des Retrovirus (i.e. virus VIH, EIAV), les Rhabdovirus (i.e.virus de la Rage), les Filovirus (i.e. Ebola, Marbourg), mais aussi des virus à ADN comme ceux de l’Hépatite B, l’Herpes simplex ou encore l’Epstein-Barr.
- Le bourgeonnement du VIH compte parmi les exemples les mieux documentés d’utilisation de la machinerie ESCRT (ESCRT-III Protein Requirements for HIV-1 Budding 2011).
En préambule, nous explicitons les couleurs visibles sur ces vidéos.
- Gag (bleu), polyprotéine virale, à ne pas confondre avec les glycosaminoglycanes (GAG), qui se polymérise, s'accumule au niveau de la membrane (blanc), provoquant une déformation initiale de la membrane.
- ESCRT-I (vert), ESCRT-II (orange) et ALIX (violet) sont recrutés par Gag.
- ESCRT-III (jaune), recruté par ESCRT-II et ALIX, complète la sphère virale qui n'est qu'à 2/3 recouvert par Gag polymérisé et libère, avec l'aide de Vps4 (rose), la vésicule de la membrane cellulaire.
Dome model
1. Dans le modèle du dôme, ESCRT-III se polymérise à partir du virion et vers le cytosol tout en formant des anneaux de plus en plus étroits (Computational Model of Membrane Fission Catalyzed by ESCRT-III 2009 et Membrane Scission by the ESCRT-III Complex 2009).
- Le dôme se rétrécit dans la même direction que celle de son développement.
- Vps4 (rose) dépolymérise ESCRT-III et une scission se produit.
- Les ESCRT sont conservées dans le virion.
Ce modèle est contesté par de nombreux auteurs car les ESCRT sont recyclées dans le cytosol, et non perdues dans les vésicules intraluminales (Super-Resolution Imaging of ESCRT-Proteins at HIV-1 Assembly Sites 2015).
2. On trouve de multiples variantes de ce modèle, dont le modèle à dôme inversé (Structure of cellular ESCRT-III spirals and their relationship to HIV budding 2014).
- ESCRT-III se développe dans une direction, mais, se rétrécit dans la direction opposée.
- les ESCRT sont libérées dans le cytosol.
Ce modèle est problématique car les protéines ESCRT doivent nuclééer du côté virion du bourgeon, et ESCRT-III doit également se rétrécir jusqu'à un point sur le côté virion, i.e. la direction du cône ESCRT-III doit s'inverser à mi-chemin de son assemblage.
- Ce remodelage spectaculaire de l'assemblage devrait être activement guidé d'une manière dépendante de l'ATP.
- VPS4 pourrait avoir ce rôle.
3. Les modèles de dôme nécessitent que les filaments ESCRT-III se rétrécissent en une pointe étroite.
- Les filaments CHMP4 devraient adopter spontanément une conformation supercourbée énergétiquement défavorable (Relaxation of Loaded ESCRT-III Spiral Springs Drives Membrane Deformation 2015).
- Or, la nucléation des CHMP4 s'effectue dans les régions membranaires fortement incurvées négativement, puis se développe vers des zones de courbure inférieure plutôt que supérieure (Negative membrane curvature catalyzes nucleation of endosomal sorting complex required for transport (ESCRT)-III assembly 2015).
Buckling model
1. Le modèle du flambage (buckling model) ou ressort à spirale (spiral spring) est quelque peu différent (Membrane buckling induced by curved filaments 2009 et Structural analysis and modeling reveals new mechanisms governing ESCRT-III spiral filament assembly 2014).

Buckling model tiré de :
Reverse-topology membrane scission
by the ESCRT complexes
(Schöneberg et coll 2017)
- ESCRT-II se nucléé là où la courbure de la membrane est négative et se polymérise vers l'extérieur du virion vers le cytosol, avec des anneaux plus larges consécutifs. Le cône est plus énergétique qu'une spirale plate.
- La conversion du cône en spirale libère la tension, mais au prix de la création de virages serrés où le virion est attaché à la membrane plasmique.
- La haute énergie de ces courbures est libérée lorsque le virion est sectionné.
- Les ESCRT sont libérées dans le cytosol à la fin.
Remarque : le flambage ou flambement est un phénomène d'instabilité d'une structure. Si cette structure est soumise à une charge progressivement croissante, lorsque la charge atteint un niveau critique, un élément peut soudainement changer de forme et on dit que la structure et le composant se sont déformés.
2. VPS4 pourrait jouer un rôle différent selon ce modèle.
a. Soit VPS4 retire le premier anneau d'ESCRT-III et ainsi détache l'assemblage ESCRT-III du Gag. Une fois détaché, le CHMP4 trop courbé s'aplatirait.
b. Soit, VPS4 modulerait la composition des sous-unités ESCRT-III.
- La copolymérisation de CHMP2 et/ou CHMP3 avec CHMP4 favorise les cônes ESCRT-III incurvés en trois dimensions (The Endosomal Sorting Complex ESCRT-II Mediates the Assembly and Architecture of ESCRT-III Helices 2012).
- VPS4 a une affinité beaucoup plus élevée pour CHMP2 que pour CHMP4. En principe, l'extraction sélective de CHMP2 à partir d'un copolymère CHMP4-CHMP2 pourrait conduire à des structures plus plates, libérant ainsi l'énergie stockée dans la membrane déformée et la rendant disponible pour entraîner la scission.
Ce modèle de flambage n'exige pas que la direction de croissance des cônes change et il prédit la libération de sous-unités ESCRT-III dans le cytosol.
3. Ce modèle est maintenant reconnu comme le plus plausible, en particulier par l'observation en temps réel du flambage membranaire par CHMP4 (Relaxation of Loaded ESCRT-III Spiral Springs Drives Membrane Deformation 2015).
- Le flambage peut directement donner lieu à des invaginations membranaires.
- Le flambage peut aussi s'exécuter en sens inverse et entraîner une scission de la membrane, i.e. les CHMP4 en excès se courbent intensément et ne peuvent se détendre qu'en s'aplatissant (ESCRT Filaments as Spiral Springs 2015).
Et le cargo ?
1. Comment les cargos ubiquitinés sont-ils triés dans les vésicules intraluminales (ILV) ?
- Dans le trafic vésiculaire, les cargos transmembranaires se lient à des complexes adaptateurs, qui à leur tour se lient à des protéines de revêtement comme la clathrine, i.e. la connexion est directe entre le recrutement du cargo et la vésiculation.
- Dans la biogenèse des endosomes ou corps multivésiculaires (MVE/MVB), les ESCRT s'accumulent au col du bourgeon, tandis que les cargos se trouvent dans la lumière, i.e. les éléments d'emballage et les cargos sont physiquement séparés.
2. Le buckling model peut ainsi compléter un ancien modèle de tri des cargo appelé modèle à cercle concentrique (A concentric circle model of multivesicular body cargo sorting 2007).
-
Le cargo (rouge sur la vidéo) attaché à ESCRT-0 est recruté et s'accumule dans un anneau périphérique de complexes ESCRT-I/ESCRT-II.
Rôle possible de ESCRT dans le tri
des cargos tiré de :
Reverse-topology membrane scission
by the ESCRT complexes
(Schöneberg et coll 2017) - Ce complexe s'entoure de ESCRT-III (jaune sur la vidéo).
- Le polymère CHMP4 se développe de telle sorte que les filaments sont sous-courbés, entraînant une tension mécanique. L'incorporation de types supplémentaires de sous-unités ESCRT-III telles que CHMP2 (bleu-vert) pourrait faciliter la conversion pour former un cône.
- La déformation de la membrane relâcherait simultanément la tension et entraînerait le cargo dans le bourgeon nouvellement formé.
- La dépolymérisation des anneaux CHMP2 par VPS4 (rose) permet à ESCRT-III de revenir à une morphologie de spirale plate et à la fission membranaire de se produire.
Conclusion
Une étude récente a mis en lumière plusieurs éléments chez la levure, qui pourraient être extrapolés malgré la variabilité du nombre et la redondance des sous-unités ESCRT-III dans les autres espèces (An ESCRT-III Polymerization Sequence Drives Membrane Deformation and Fission 2020).
1. La déformation de la membrane est couplée à des changements de forme des filaments associés à des changements de stoechiométrie des sous-unités.

Recrutement en cascade de ESCRT-III
(Figure : vetopsy.fr d'après Davies et coll)
a. Le recrutement des protéines est défini par trois paramètres essentiels pour contrôler l'ordre temporel de la séquence :
- l'affinité des sous-unités pour la membrane,
- l'affinité spécifique entre les sous-unités, car les sous-unités précédentes recrutent les suivantes,
- le rôle ATPasique de Vps4 qui, en alimentant le renouvellement des sous-unités, entraîne la progression unidirectionnelle.
Ces principaux aspects de la séquence de polymérisation de l'ESCRT-III sont différents de l'endocytose clathrine-dépendnte, où la courbure membranaire et le métabolisme des phosphoinositides sont cruciaux (Mechanisms of clathrin-mediated endocytosis 2018). Il semblerait que pour ESCRT-III, la courbure n'est pas critique pour conduire la séquence, même si elle a une influence sur la dynamique.
b. Même si les spirales Snf7/CHMP4 plates peuvent se déformer pour provoquer le flambement (
- Le premier ajout de Vps2/CHMP2-Vps24/CHMP3, forme un filament secondaire le long des filaments Snf7/CHMP4 (Dynamic subunit turnover in ESCRT-III assemblies is regulated by Vps4 to mediate membrane remodelling during cytokinesis 2017). Il rigidifie le polymère augmentant son potentiel de flambage spontané (Anisotropic ESCRT-III architecture governs helical membrane tube formation 2020).
- Par la suite, l'échange de Vps24/CHMP3 contre Did2/CHMP1 se traduit par la formation de spirales coniques.
- Enfin, l'élimination des filaments par Vps4 déclenche la formation de filaments hélicoïdaux.
c. Au niveau moléculaire, l'assemblage et le désassemblage séquentiels de copolymères constitués d'un filament plat (Snf7/CHMP4) et hélicoïdal (Vps2/CHMP2-Did2/CHMP1) interviennent dans ce flambage, i.e. les deux filaments ayant une inclinaison différente dans leur interface de liaison membranaire par rapport à l'axe principal du filament.
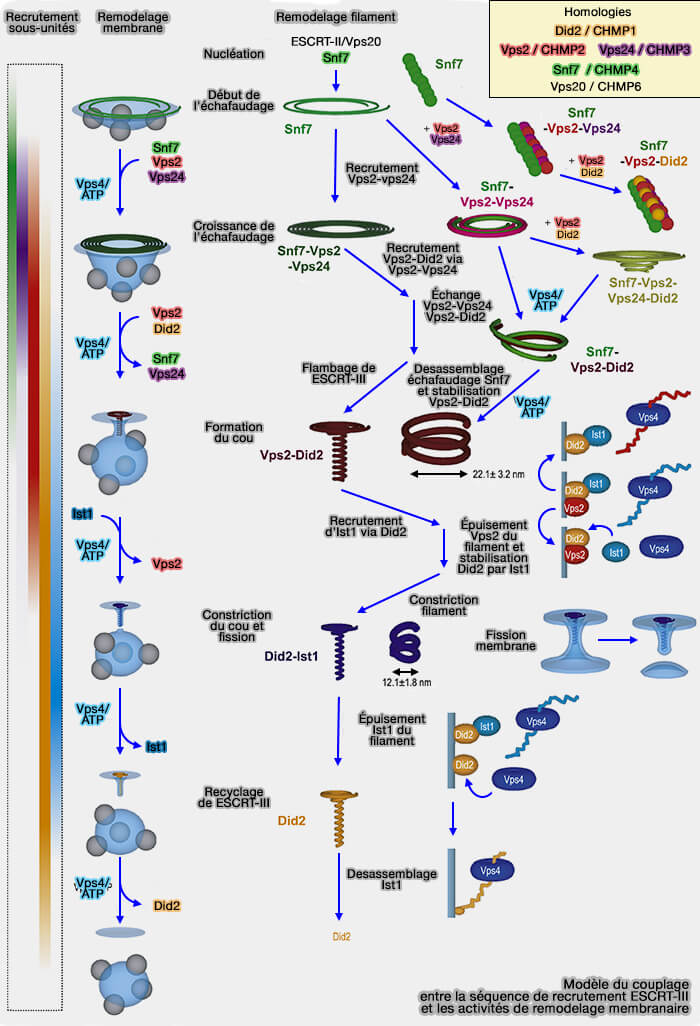
(Figure : vetopsy.fr d'après Davies et coll)
2. La séquence oriente la polymérisation d'ESCRT-III dans les cols membranaires.
3. Le dernier complexe de la séquence, Did2/CHMP1-Ist1, serait compétent pour promouvoir la fission membranaire.
a. L'assemblage final Did2/CHMP1-Ist1 de la séquence rétrécit les tubes membranaires à 4,8 nm (Membrane constriction and thinning by sequential ESCRT-III polymerization 2020).
- Did2/CHMP1-Ist1 est le seul polymère ESCRT-III identifié à ce jour qui est compatible avec les tailles de constriction qui conduire à la fission.
- Did2/CHMP1-Ist1 peut s'assembler autour ou à l'intérieur des cols membranaires in vivo (An ESCRT-spastin interaction promotes fission of recycling tubules from the endosome 2013) et in vitro (Structure and membrane remodeling activity of ESCRT-III helical polymers 2015) et induire une fission dans les deux orientations.
b. Or l'activité ATPasique de Vps4 est requise pour la constriction et la fission.
- Comme la fission membranaire induite par la dynamine (GTP-dependent twisting of dynamin implicates constriction and tension in membrane fission 2006), des forces externes supplémentaires pourraient être nécessaires pour finaliser la progression des structures membranaires fortement resserrées vers la fission.
- Les origines possibles de telles forces au cours de l'activité de l'ESCRT-III pourraient être l'encombrement des protéines et des cargos dans la formation d'ILV ou la migration cellulaire en abscission.

Comprendre comment le même co@mplexe, dans des orientations différentes, resserre encore suffisamment la membrane pour déclencher la fission, et si d'autres acteurs importants, tels que les cargos , sont essentiels pour la fission, reste une question ouverte pour les études futures (Constitutively active ESCRT-II suppresses the MVB-sorting phenotype of ESCRT-0 and ESCRT-I mutants 2015).
Retour à les endosomes
Biologie cellulaire et moléculaireMembrane plasmiqueNoyauCytoplasmeMitochondriesSystème endomembranaireRéticulum endoplasmiqueAppareil de GolgiEndosomesLysosomesPeroxysomesProtéasomesCytosquelettemicrofilaments d'actineFilaments intermédiairesMicrotubulesMatrice extracellulaireReproduction cellulaireBiochimieTransport membranaireMoteurs moléculairesVoies de signalisation


