Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
2. Adaptateurs à la clathrine
2.b Adaptateurs alternatifs
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Dans l'endocytose clathrine-dépendante (CME), le récepteur du cargo peut recruter un adaptateur alternatif aux adaptateurs classiques, car la clathrine ne peut se lier à la membrane.
(Figure : vetopsy.fr)
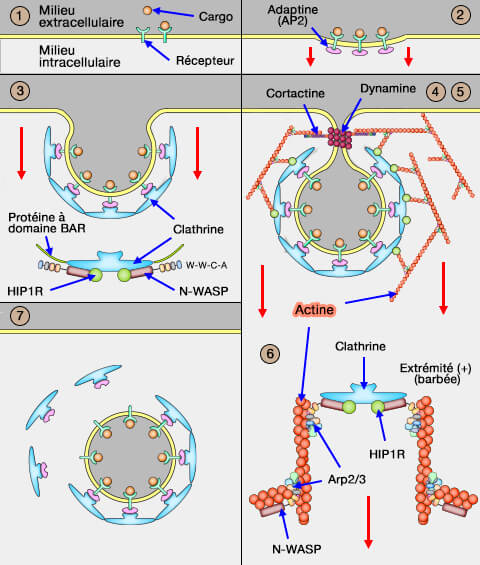
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
2. Le complexe récepteur-cargo se couple ensuite à une protéine nommée adaptateur à la clathrine, car la cage de clathrine ne peut se lier à la membrane qui comprend :
- a. les adapteurs classiques, i.e. adaptines, CALM et AP80,
- b. les adaptateurs alternatifs,
- c. des protéines à domaines BAR qui se lient à ces adapteurs déforment la membrane pour former une invagination légère, qui va s'approfondir par la suite (
déformation de la membrane).
2b. Adaptateurs à la clathrine : adaptateurs alternatifs
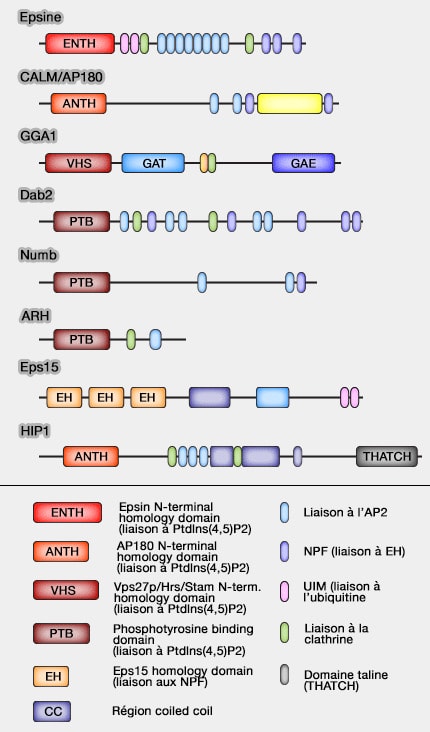
Epsines
Vue d'ensemble
Les epsines sont une famille de protéines qui courbent la membrane en se liant à la clathrine et à d'autres protéines accessoires, i.e. permettant l'endocytose (Epsin deficiency impairs endocytosis by stalling the actin-dependent invagination of endocytic clathrin-coated pits 2014).
(Figure : vetopsy.fr)
Elles jouent un rôle essentiel dans la down-régulation du récepteur du facteur de croissance épidermique (EGF : (Epidermal Growth Factor) et dans l'activation des voies Notch et des GTPases Rho lors du développement embryonnaire des métazoaires.
-

Pour tout savoir sur l'epsine et son abondante bibliographie, bous pouvez lire : The epsin protein family: coordinators of endocytosis and signaling (2012).
1. L'epsine 1 (EPN1) et l'epsine 2 (EPN2), impliqués dans l'endocytose médiée par un récepteur, se lient à l'AP-2 (surtout au niveau cérébral).
2. L'epsine 4 (EPN4 ou CLINT1) intervient dans la voie sécrétoire entre le réseau trans-Golgi et les endosomes, se lie à l'AP-1 et au GGA.
3. L'epsine 3 est impliquée dans la migration des kératinocytes, des cellules pariétales gastriques et de nombreux carcinomes.
Remarque : l'epsine est capable de médier la fission vésiculaire dans les cellules appauvries en dynamine.
Les molécules d'epsine présentes au niveau du col d'une vésicule naissante pourraient fournir la force qui déstabilise le col de la vésicule, conduisant ainsi à la fission (Membrane Fission Is Promoted by Insertion of Amphipathic Helices and Is Restricted by Crescent BAR Domains 2012).
2. Les epsines, sont impliquées dans la reconnaissance de cargos ubiquitinés à la membrane plasmique, comme EPS15 (Epidermal growth factor receptor ([EGFR] Pathway Substrate 15) par exemple.
Structure des epsines
L'epsine comprend plusieurs domaines.
(Figure : vetopsy.fr d'après N.V. Popova)
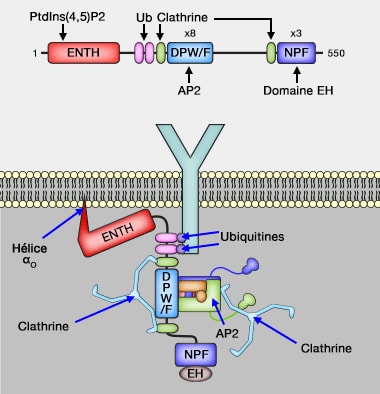
1. Le domaine N-terminal ENTH ou Epsin N-Terminal homology, d'environ 150 acides aminés de long, est presque identique :
- au domaine VHS des GG,
- au domaine ANTH des Hip1.
Ce domaine ENTH se lie au PI(4,5)P2 ou PIP2 de la membrane.
- Cette liaison provoque un changement de conformation
qui ajoute une hélice α à la fin du domaine (
courbure membranaire).
- Cette hélice (α0) s'insère dans la couche cytoplasmique et pourrait constituer la première phase de la courbure de la membrane (Curvature of clathrin-coated pits driven by epsin 2002).
Ce domaine régule aussi des voies de signalisation.
2. Deux ou trois domaines UIM (Ubiquitin Interacting Motifs) suivent le domaine ENTH.
Ces domaines se lient aux cargos ubiquitinés (une fois jusqu'à 4 fois) pour pouvoir s'accrocher à l'epsine (The Ubiquitin-Interacting Motifs Target the Endocytic Adaptor Protein Epsin for Ubiquitination 2002 et Solution structure of Vps27 UIM–ubiquitin complex important for endosomal sorting and receptor downregulation 2003).
3. Puis, on trouve une région déstructurée qui possède :
- deux boîtes à clathrine (CBM) chez les mammifères, comprenant le motif LΦZΦZ (leucine, Φ - acide aminé hydrophobe - et Z - acide aminé polaire -) qui se lie au domaine C-terminal de la chaîne lourde de la clathrine,
- huit répétitions DP(W/F) - aspartate-proline-tryptophane/phénylalanine - qui se lient à l'adaptateur AP-2.

(Figure : vetopsy.fr d'après Jin et coll)
4. La région C-terminale se finit par 2 ou 3 répétitions NPF (asparagine-proline-phenylalanine) qui reconnaissent le domaine EH (Eps15 Homology ) de nombreuses protéines EHD impliquées dans la courbure et la fission membranaire, comme celles des endosomes, en particulier les endosomes de recyclage, régulant ainsi le recyclage endocytaire ainsi que dans les cavéoles.
a. L'intersectine/Dap160 est une protéine d'échafaudage endocytaire, qui contient deux domaines EH à son extrémité N-terminale, qui joue un rôle important :
- dans la régulation de l'activation induite par Ras des kinases MAPK,
- d'autres processus régulés par la GTPase qui recrutent l'actine.
L'intersectine contient aussi 5 domaines SH3 qui peuvent se lier à de nombreuses protéines dont FCHSD2 ou FCH and double SH3 domains protein 2 (
b. P0B1 (Partner of RalBP1), partenaire de RalBP1 (Ral-binding protein 1) effecteur de la petite GTPase RAL, qui possède un domaine EH à son extrémité N-terminale, joue un rôle dans la migration cellulaire (Interaction of POB1, a Downstream Molecule of Small G Protein Ral, with PAG2, a Paxillin-binding Protein, Is Involved in Cell Migration 2002).
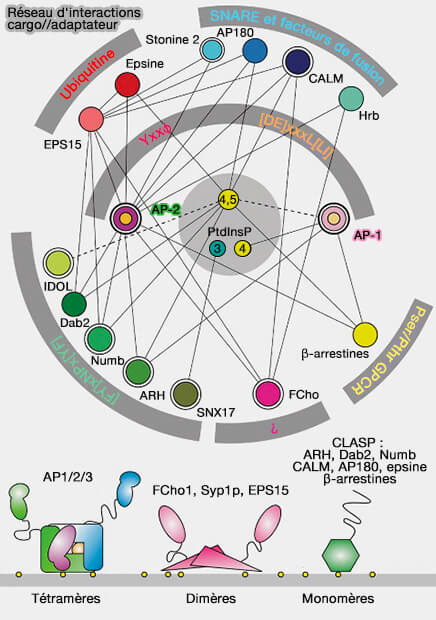
Autres adaptateurs
Bien d'autres adaptateurs existent (Clathrin-Mediated Endocytosis and Adaptor Proteins 2013).
(Figure : vetopsy.fr d'après Traub et Bonifacino)
1. EPS15 (Epidermal growth factor receptor ([EGFR] Pathway Substrate 15) est impliqué dans les premiers stades de l'endocytose et peut courber la membrane avec FCho1/2 et l'AP-2 (
Remarque : EPS15B est une sous-unité de ESCRT-0 impliquée dans la voie de l'internalisation de l'EGFR, récepteur à EGF ou facteur de croissance épidermique…
2. L'ARH ou LDLRAP1 (Low-Density Lipoprotein Receptor Adaptor Protein 1) est une protéine cytosolique qui contient un domaine de liaison à la phosphotyrosine (PTB) se liant à la queue cytoplasmique de LDLR (LDL Receptor).

L'endocytose de LDLR est étudiée dans un chapitre spécial.
3. Hip1 (Huntingtin-interacting protein 1) et HIP1R (HIP1-related) ont un rôle important dans le recrutement de l'actine pour le détachement vésiculaire.

Hip1 (Huntingtin-interacting protein 1) et HIP1R (HIP1-related) sont étudiés dans le chapitre : recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine dans l'endocytose.
4. Les protéines Hrs (Hepatocyte-growth-factor receptor substrate) et STAM (Signal-Transducing Adaptor Molecule) font partie du complexe ESCRT-0 comme l'arrestine EPS15 pour interagir avec les cargos ubiquitinés.

Les protéines Hrs (Hepatocyte-growth-factor receptor substrate) et STAM (Signal-Transducing Adaptor Molecule) sont étudiées dans le chapitre sur le complexe ESCRT-0
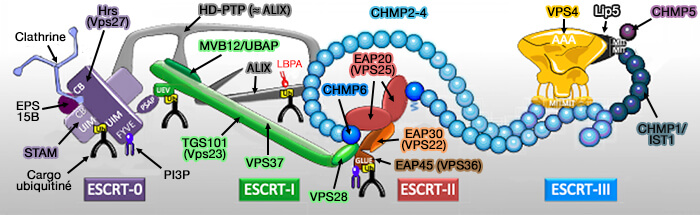
(Figure : vetopsy.fr d'après Christ et Hill)
5. Dab2 (Disabled2) est une protéine adaptatrice, largement exprimée, impliquée dans des voies de signalisation dans lesquelles intervient un récepteur transmembranaire (comme dans certains modèles de signalisation Wnt).
Dab2 contient (The “intelligent adaptor” Dab2 regulates clathrin-mediated endocytosis 2012) :
- un domaine N-terminal PTB (PhosphoTyrosine Binding) qui se lie aux membres de la famille des LDLR et aux phosphoinositides,
- des domaines qui se lient à la clathrine, l'AP-2, la myosine VI, ce qui facilite l'assemblage des vésicules de clathrine pour l'endocytose du cargo et la fission vésiculaire.

(Figure : vetopsy.fr d'après Komolov et Weiss)
5. Les β-arrestines reconnaissent des motifs phosphorylés, notamment des récepteurs couplés aux protéines G (GPCR).

Les β-arrestines sont étudiées dans un chapitre spécial.
6. Numb est une protéine conservée au cours de l'évolution qui joue un rôle important dans l'adhésion cellulaire, la migration, la polarité et la détermination du destin cellulaire (The Multitasker Protein: A Look at the Multiple Capabilities of NUMB 2023).
a. Numb joue un rôle dans le développement des dendrites avec l'intersectine (
b. Numb est impliquée dans l'endocytose de la protéine Niemann-Pick C1-like 1 (NPC1L1) qui absorbe le cholestérol de la lumière de l'intestin grêle et de la membrane canaliculaire des hépatocytes.
b. Numb joue un rôle controversé dans la pathogenèse de certains cancers.
- Soit c'est un suppresseur tumoral par sa régulation négative de la voie de signalisation Notch et de la prolifération cellulaire en favorisant la dégradation endocytaire de Notch (Endocytosis by Numb breaks Notch symmetry at cytokinesis 2012), ou en empêchant l'ubiquitination médiée par MDM2 de p53 (NUMB controls p53 tumour suppressor activity 2008).
- Soit il les favorise par sa liaison à la kinase du lymphome anaplasique (ALK), un récepteur tyrosine kinase activé de manière aberrante dans plusieurs formes de cancer. Cette interaction régule l'endocytose et l'activité de l'ALK (NUMB regulates the endocytosis and activity of the anaplastic lymphoma kinase in an isoform-specific manner 2018).
7. D’autres adaptateurs reconnaissent des régions plus spécifiques de certaines protéines ou familles de protéines.
Par exemple, PICALM (PhosphatidylInositol-Binding Clathrin Assembly) est capable de reconnaître les domaines SNARE de VAMP2/synaptrobrévine 2 (pour Vesicle-Associated Membrane Protein 2), VAMP3 et VAMP8 (The Molecular Basis for the Endocytosis of Small R-SNAREs by the Clathrin Adaptor CALM 2011).
3. Formation de la cage de clathrine
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseCavéolesVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


