Domaines protéiques
Domaines UBD (Ubiquitin-binding domains)

Les domaines de liaison à l’ubiquitine appelés UBD (Ubiquitin Binding Domain) interagissent par des liaisons non covalentes avec des protéines mono- ou polyubiquitinées et sont impliqués dans les interactions protéine/protéine, en particulier dans la signalisation cellulaire.
L'ubiquitination (ou ubiquitinylation) est une modification post-traductionnelle qui aboutit à la fixation covalente d'une (ou de plusieurs) protéine d'ubiquitine sur la protéine substrat.
Classification des UBD

Vous pouvez lire : Ubiquitin-binding domains (2006) et Ubiquitin-binding domains — from structures to functions (2009).
Les UBD comptent plus de 20 familles différentes et leur nombre ne cesse d'augmenter.
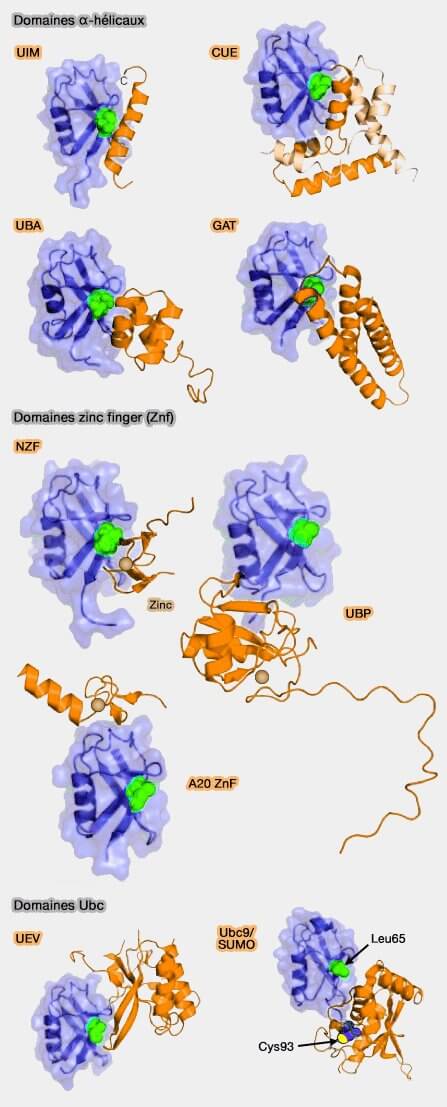
(Figure : vetopsy.fr d'après Hurley)
Ces domaines sont relativement petits (50 à 150 résidus).
1. La classe la plus nombreuse des UBD, de structure α-hélicale se lie au patch hydrophobe Ile44, comprend :
- les UBA (UBiquitin Associated),
- les UIM (Ubiquitin-Interacting Motif),
- les DUIM (Double-sided UIM),
- les MIU (Motif Interacting with Ubiquitin),
- les CUE (Coupling of Ubiquitin conjugation to Endoplasmic reticulum degradation),
- les GAT :
- GGA (Golgi-localized et Gamma-ear-containing,
- ARF (ADP-ribosylation-factor)-binding protein,
- TOM (target of Myb)…
2. La deuxième classe, celle des zinc finger (ZnF), reconnaît trois régions différentes sur la surface de l'ubiquitine, comprend :
- les NZF (Npl4 ZnF),
- les UBZ (UBiquitin-binding ZnF),
- l'A20 ZnF,
- les ZnF UBP (UBiquitin-specific processing Protease),
- les UBZ (UBiquitin-binding ZnF)…
3. Une classe comporte un domaine PH (Pleckstrin Homology), comprend :
- les PRU (Pleckstrin-like Receptor for Ubiquitin),
- les GLUE (GRAM-Like Ubiquitin binding in EAP45).
4. Une classe, les Ubc (Ubiquitin-Conjugating -like domain), comprend :
5. Une classe, comportant d'autres domaines, comprend :
- les Jab1/MPN,
- les domaines VHS (VPS27, Hrs et STAM), présents en particulier chez Hsr et STAM du complexe ESCRT-0,
- les PFU (PLAA Family Ubiquitin binding),
- les domaines SH3.
Rôles des UBD
1. Les protéines à UBD regroupent de nombreuses protéines, et en particulier des E3 ligases, des UBL (UBiuquitin-Like), des DUB (déubiquitinaes), et en particulier les USP ou encore, des sous-unités du protéasome.
Certaines protéines à UBD contiennent aussi un domaine UBL, domaine qui peut lui-même interagir avec des domaines UBD, soit au sein de la même protéine, soit entre deux protéines distinctes.
Ces protéines peuvent adresser des substrats ubiquitinés au protéasome, en interagissant avec ces substrats via leurs domaines UBD et avec le protéasome via leurs domaines UBL.
2. La conjugaison et la déconjugaison de l'ubiquitine et des UBL (ubiquitin-like protein) aux protéines cellulaires sont des processus régulés de l'homéostasie cellulaire (Substrate specificity of the ubiquitin and Ubl proteases 2016).
Les interactions avec les UBD sont :
- dépendantes de la mono- ou de la polyubiquitination, et dans ce cas de la conformation de la chaîne d'ubiquitine : compacte (K48) ou linéaire (canonique ou K63),
- complexes et dépendent de nombreux facteurs : multiplication des sites dans les protéines, oligomérisation des protéines, interactions variées dans les complexes de signalisation ou dans les différents espaces cellulaires (endosomes…).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


