Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
2. Adaptateurs à la clathrine
2c. Déformation et invagination de la membrane
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

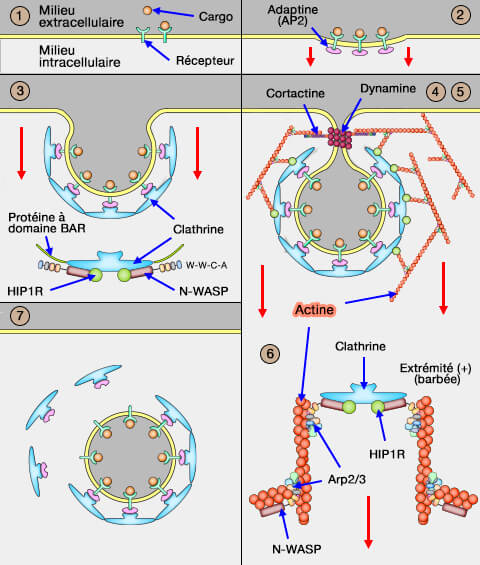
Dans l'endocytose clathrine-dépendante (CME), l'invagination de la membrane est provoquée par la formation d'une dépression peu profonde faisant intervenir des protéines à domaine BAR.
(Figure : vetopsy.fr)
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
2. Le complexe récepteur-cargo se couple ensuite à une protéine nommée adaptateur à la clathrine, car la cage de clathrine ne peut se lier à la membrane qui comprend :
- a. les adapteurs classiques, i.e. adaptines, CALM et AP80,
- b. les adaptateurs alternatifs,
- c. des protéines à domaines BAR qui se lient à ces adapteurs déforment la membrane pour former une invagination légère, qui va s'approfondir par la suite (
déformation de la membrane).
2c. Déformation de la membrane

Les résultats d'expériences contradictoires à ce stade montrent qu'un certain nombre de protéines peuvent procéder à l'initiation de l'endocytose (From uncertain beginnings : Initiation mechanisms of clathrin-mediated endocytosis 2013) :
- deux adaptines avec un triskélion,
- la courbure de la membrane par une protéine BAR ou autre (epsine…),
- le regroupement des cargos,
- le recrutement d'un gradient de lipides spécifiques comme le PI(4,5)P2.

(Figure : vetopsy.fr d'après Daumke et coll)
Des molécules à domaine N-BAR, comme l'amphiphysine, ou à domaine F-BAR, comme FCho1, la FCho2…, mais aussi EPS15 sont capables de détecter des lipides de courbure différente et peuvent ainsi courber la membrane (BAR Domain Scaffolds in Dynamin-Mediated Membrane Fission 2014).

Les domaines BAR et leurs fonctions sont étudiés dans des chapitres spéciaux.
PI(4,5)P2
La membrane est enrichie en phosphatidylinositol 4,5-bisphosphate ou PI(4,5)P2) sans que l'on sache le mécanisme qui provoque ce processus.
PI(4,5)P2 :
- permet la formation de microdomaines en fonction de la demande de diverses fonctions cellulaires,
- favorise la polymérisation de l'actine en activant un certain nombre de modulateurs de l'actine (Regulation of actin assembly by PI(4,5)P2 and other inositol phospholipids: an update on possible mechanisms, 2018).
Protéines de courbure
1. La CME est nucléée par co-assemblage :
- de EPS15 (Eps15: a multifunctional adaptor protein regulating intracellular trafficking 2009),
- de FCHo au domaine F-BAR peu incurvé,
- avec des adaptateurs endocytaires tels que AP-2 et la clathrine sur ces sites membranaires enrichis en PI(4,5)P2 (BAR Domain Scaffolds in Dynamin-Mediated Membrane Fission 2014).

(Figure : vetopsy.fr d'après Sochaki et coll)
2. FCho1 et FCho2 (FCH and mu domain containing endocytic adaptor 2) jouent probablement un rôle clé dans la restructuration locale de l'AP-2, car elles font partie des premières protéines à marquer un CCS (Clathrin-Coated Structures) naissant (FCHo Proteins are Nucleators of Clathrin-Mediated Endocytosis 2010 et A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis 2011).
a. Elles affectent directement la conformation de l'AP-2 (The membrane-associated proteins FCHo and SGIP are allosteric activators of the AP2 clathrin adaptor complex 2014).
b. Les deux paralogues contiennent :
- un domaine F-BAR peu incurvé, i.e. domaine EFC sur la figure (
domaine BAR et courbure de membrane),
- un segment intrinsèquement désordonné d'environ 200 résidus qui s'associe à AP-2 (A clathrin coat assembly role for the muniscin protein central linker revealed by TALEN-mediated gene editing 2014),
- un domaine d'homologie μ (μHD), qui remplace le domaine SH3 C-terminal typique de la plupart des protéines à domaine BAR, qui se lie à EPS15.

Vous pouvez lire : Transient Fcho1/2⋅Eps15/R⋅AP-2 Nanoclusters Prime the AP-2 Clathrin Adaptor for Cargo Binding (2016).
3. À l'heure actuelle, de nombreuses études sont effectuées sur la séparation de phase liquide-liquide (LLPS) qui pourrait contribuer à la génération de courbures endocytaires (Liquid-like protein interactions catalyze assembly of endocytic vesicles 2021).
- Eps15 et Fcho1/2 reposent sur des interactions faibles et de type liquide pour favoriser l'assemblage de gouttelettes de protéines in vitro, ce qui peut soutenir l'endocytose médiée par la clathrine.
- De même, Ede1, l'homologue Eps15 de la levure, peut générer une phase liquide séparée pour nucléer les patchs endocytaires (Condensation of Ede1 promotes the initiation of endocytosis 2022).

(Figure : vetopsy.fr d'après Day et coll)
4. Eps15 engage AP-2 et Fcho1/2 de manière non compétitive, et un modèle pourrait être le suivant.
- 1. Le domaine F-BAR, EFC domain sur la figure, de Fcho1/2 s'ancre sur la membrane plasmique chargée négativement.
- 2. Les complexes Fcho1/2⋅Eps15/R pourraient se lier séquentiellement pour recruter l'AP-2, aidés par l'interaction de la sous-unité α/β2 de l'AP-2 avec PI(4,5)P2.
- 3. Un groupe local mais temporaire à trois composants dépendant des motifs DPF (Asp-Pro-Phe) de l'Eps15/R permettrait à AP-2 de s'attarder à proximité de Fcho1/2 pour faire progresser l'assemblage de la structure recouverte de clathrine (CCS).
Cette interaction conduit à :
- 4. un réarrangement conformationnel de l'AP-2 en une forme " ouverte " ou active qui facilite l'engagement du cargo.
- 5. la libération de la charnière de sous-unité β2 de l'AP-2 - pour favoriser la polymérisation de la clathrine.

(Figure : vetopsy.fr d'après Ma et coll)
4. À mesure que la concentration locale d'AP-2 augmente au niveau de la zone d'assemblage, d'autres adaptateurs/CLASP entrants, i.e. plus abondants, tels que Dab2, ARH, l'epsine et CALM, peuvent supplanter Eps15/R pour la liaison des appendices, puisqu’ils se lient également à PI(4,5)P2, à la clathrine et au cargo.
5. La maturation du CCP s'accompagne d'un remodelage membranaire et d'une conversion partielle de PI(4,5)P2 en PI(3,4)P2 catalysée par la phosphorylation médiée par la phosphatidylinositol 3-kinase C2α (PI3KC2α).
- PI(3,4)P2 est nécessaire pour recruter les nexines (SNX) à domaine BAR, i.e. SNX9/18 contenant le domaine PX dans les CCP en maturation qui subissent une constriction du col de la vésicule pour former des intermédiaires en forme de Ω (Endocytosis, metastasis and beyond: Multiple facets of SNX9 2017).
- Les protéines du domaine BAR hautement incurvées (N-BAR), l'endophiline et/ou l'amphiphysine, s'assemblent autour du col rétréci de la vésicule et facilitent le recrutement de la dynamine.
Remarque : l'hydrolyse du GTP dans la dynamine catalyse finalement la fission membranaire, suivie d'un détachement accompagné d'une hydrolyse séquentielle médiée par la synaptojanine de PI(4,5)P2 en PI ou éventuellement de PI(3,4)P2 en PI(3)P pour mener aux endosomes.
6. De nombreuses molécules à domaine BAR lient la membrane au cytosquelette et favorisent la polymérisation de l'actine (
- Certaines se lient par leur domaine SH3 au domaine PRD dss NPF (Nucleation Promoting Factor comme WASP/WAWE. Cette liaison provoque la dimérisation du domaine VCA des NPF, puissant activateur du complexe Arp2/3.
- D'autres sont des effecteurs ou des régulateurs des GTPases de la famille Rho.
- D'autres enfin se lient et mettent en réseau directement les microfilaments d'actine (protéines de réticulation).
4. Recrutement des NPF, du complexe Arp2/3
et polymérisation de l'actine
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


