Lipides
Formation des lipoprotéines
Protéines de lipidation des apoB
PLTP, CIDEB
et CGI-58/ABHD5
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
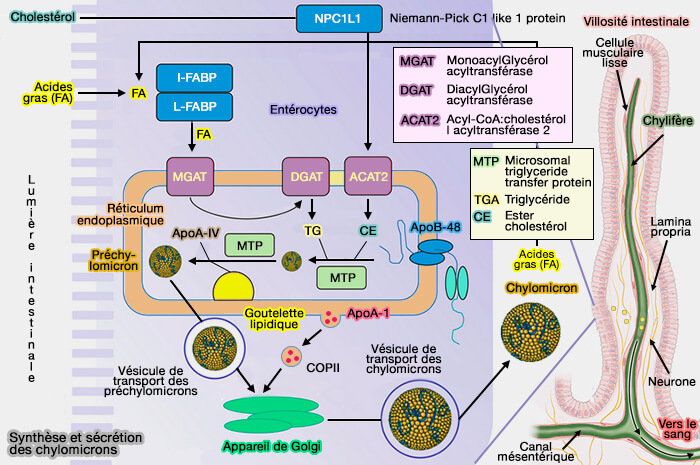
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La lipidation des apoB peut être réalisée, en dehors de MTTP, par PLTP, CIDEB et CGI-58/ABHD5.
(Figure : vetopsy.fr)
En plus de MTTP (Microsomal Triglyceride Transfer Protein), l'assemblage de B-lps peut être assistée par plusieurs autres protéines :
- PLTP (PhosphoLipid Transfer Protein), i.e. protéine de transfert des phospholipides (PL),
- CIDEB (Cell Death-Inducing DFF45-like Effector B), i.e. effecteur B de type DFF45 induisant la mort cellulaire,
- CGI-58/ABHD5.
PLTP (PhosphoLipid Transfer Protein)
PLTP (PhosphoLipid Transfer Protein) joue plusieurs rôles dans le métabolisme des lipoprotéines, en particulier dans la biogenèse et le remodelage des HDL (lipoprotéines de haute densité).

PLTP est étudié dans un chapitre spécifique.
1. Outre ces rôles multiples sur les HDL, PLT jouerait un rôle dans :
- la première étape de lipidation des apoB, i.e. le déficit en PLTP réduit la sécrétion des apoB (Phospholipid Transfer Protein Plays a Major Role in the Initiation of Apolipoprotein B-containing Lipoprotein Assembly in Mouse Primary Hepatocytes 2015),
- la deuxième étape de l'assemblage des B-lps, à savoir l'extension du coeur (Liver phospholipid transfer protein (PLTP) expression with a PLTP-null background promotes very low-density lipoprotein production in mice 2012).
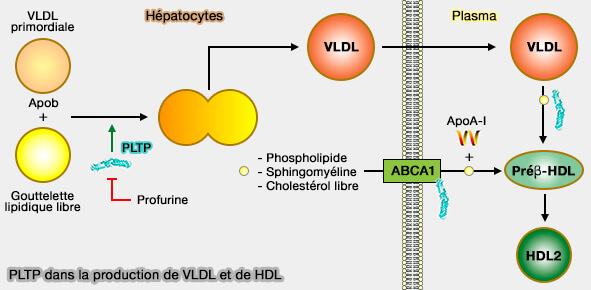
(Figure : vetopsy.fr d'après Jiang et Yu)
2. La PLTP pourrait induire la fusion des VLDL (lipoprotéines de très basse densité) primordiaux avec des gouttelettes lipidiques sans apoB, facilitant ainsi la lipidation de l'apoB et la sécrétion des VLDL.
a. Le déficit en PLTP chez la souris atténue la sécrétion de VLDL par le foie, tandis que la surexpression de PLTP favorise la surproduction de VLDL (Liver phospholipid transfer protein (PLTP) expression with a PLTP-null background promotes very low-density lipoprotein production in mice 2012).
b. Le prodomaine de la dégradation protéasomique de la PLTP par la furine peut empêcher la production de VLDL (Prodomain of Furin Promotes Phospholipid Transfer Protein Proteasomal Degradation in Hepatocytes 2018).
c. Contrairement à l'inhibition de la MTTP (Microsomal Triglyceride Transfer Protein) qui provoque une stéatose hépatique chez la souris et l'homme, les souris déficientes en PLTP n'ont pas d'accumulation de lipides dans le foie.
(Figure : vetopsy.fr d'après Sirwi et coll)
Potentiellement, l'inhibition de la PLTP chez l'homme pourrait entraîner une réduction des VLDL et des LDL (lipoprotéines de basse densité) sans conséquence de la stéatose hépatique.

La PLTP jouerait probablement un rôle moins important dans l'assemblage des lipoprotéines dans l'intestin que dans le foie.
Protéines membranaires
du RE et des LD
CIDEB (Cell Death-Inducing
DFF45-like Effector B)
1. CIDEB (Cell Death-Inducing DFF45-like Effector B), i.e. effecteur B de type DFF45 induisant la mort cellulaire, est une protéine associée à la membrane des entérocytes et des hépatocytes qui se localise dans :
- les gouttelettes lipidiques cytoplasmiques (cLD, Lipid Droplets),
- le réticulum endoplasmique (RE) lisse,
- l'appareil de Golgi.
De plus, CIDEB interagit avec apoB (Intracellular Trafficking and Secretion of VLDL 2013).

Les protéines CIDE sont étudiées dans un chapitre spécifique.
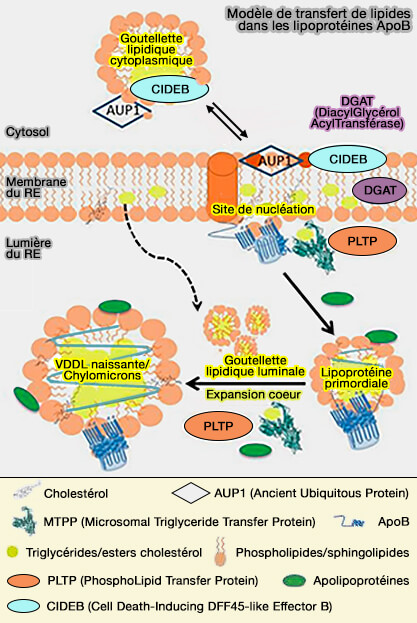
2. CIDEB pourrait faciliter le transport des triglycérides (TG) des cLD vers la membrane du RE au niveau des sites de contact membranaire (MCS) et, au sein de la membrane du RE, du site de synthèse des lipides vers l'apoB.
En l'absence de CIDEB, les TG sont principalement détournés vers les cLD, ce qui entraîne la production de lipoprotéines pauvres en TG et une augmentation de la masse de TG dans les cLD (Cideb, an ER- and Lipid Droplet-Associated Protein, Mediates VLDL Lipidation and Maturationsw by Interacting with Apolipoprotein B 2009).
3. En plus de son rôle dans l'assemblage des lipoprotéines, CIDEB pourrait contribuer au transport des VLDL (lipoprotéines de très basse densité) via les vésicules de transport des VLDL ou VTV (CideB Protein Is Required for the Biogenesis of Very Low Density Lipoprotein (VLDL) Transport Vesicle 2012 et Intracellular trafficking and secretion of VLdL 2012).
a. CIDEB se lie à l'apoB et interagit avec Sar1 et Sec24 pour former une vésicule COPII nécessaire à la formation de vésicules de grande taille, la VTV, à partir des membranes hépatiques du réticulum endoplasmique (RE).
CIDEB n'interagit pas avec les protéines sécrétoires naissantes telles que l'albumine et n'est pas présent dans les PTV (Protein Vesicle Transport).
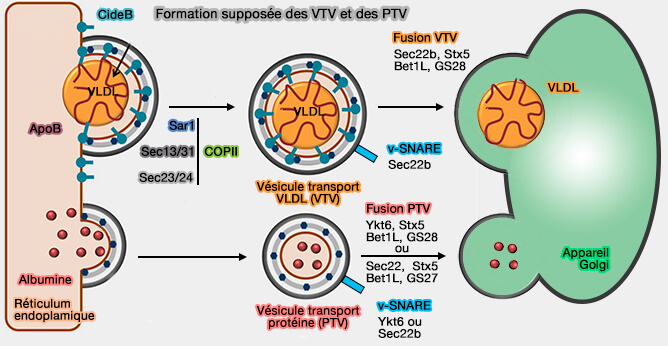
(Figure : vetopsy.fr d'après Tiwari et coll et Siddiqi et coll).
b. La fusion des VTV avec l'appareil de Golgi nécessiterait un complexe SNARE formé de (
- Sec22b comme v-SNARE,
- Stx5-5, Bet1L (GS15) et GS28 (GOS-28 ou GOSR1) comme t-SNARE.
AUP1 (Ancient Ubiquitous Protein 1)
Comme CIDEB, AUP1 (Ancient Ubiquitous Protein 1) est également une protéine membranaire du RE et un composant des cLD (AUP1 (Ancient Ubiquitous Protein 1) Is a Key Determinant of Hepatic Very-Low–Density Lipoprotein Assembly and Secretion 2017).
1. AUP1, protéine hautement conservée de 410 acides aminés, comprend plusieurs domaines (Ancient Ubiquitous Protein 1 (AUP1) Localizes to Lipid Droplets and Binds the E2 Ubiquitin Conjugase G2 (Ube2g2) via Its G2 Binding Region 2011) :
- un long domaine hydrophobe qui s'insère dans les membranes,
- un domaine acyltransférase (AT) avec trois motifs conservés sur quatre (Substrate Specificity of Acyltransferase Domains for Efficient Transfer of Acyl Groups 2018),
- un domaine CUE (Coupling of Ubiquitin conjugation to Endoplasmic reticulum degradation), i.e. domaine UBD qui se lie à l'ubiquitine et favorise la mono-ubiquitination intramoléculaire et la dégradation associée au RE, qu'on retrouve aussi dans TOLLIP,
- un domaine G2BR qui se lie à une E2 (ubiquitin-conjugating enzyme), HRD1 étant la E3 (Human HRD1 Is an E3 Ubiquitin Ligase Involved in Degradation of Proteins from the Endoplasmic Reticulum 2004).
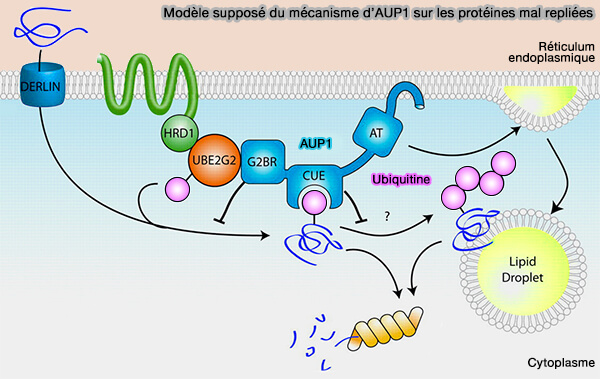
(Figure : vetopsy.fr d'après Klemm et coll).
2. AUP1 est impliquée dans le contrôle de la qualité de la synthèse des protéines et des cLD en augmentant l'ubiquitination des protéines associées (Dual Role of Ancient Ubiquitous Protein 1 (AUP1) in Lipid Droplet Accumulation and Endoplasmic Reticulum (ER) Protein Quality Control 2011).
- Sur la base de profils d'expression similaires et d'une interaction avec l'apoB et des effets opposés sur la biosynthèse des lipoprotéines, AUP1 pourrait s'opposer à la fonction CIDEB au cours des premiers stades de la lipidation de l'apoB.
- Des changements dynamiques dans les niveaux cellulaires de ces deux protéines peuvent contrôler l'assemblage des lipoprotéines.
Il reste à déterminer si AUP1 joue un rôle dans la formation de cLD et l'assemblage des lipoprotéines in vivo et dans les cellules intestinales.
Remarque : CGI-58/ABHD5 (Comparative gene identification-58 ou α/β-hydrolase domain-containing 5) est un membre d'une grande famille de protéines contenant un pli ou repliement α/β-hydrolase.
- CGI-58/ABHD5 est bien connu comme co-activateur de ATGL (Adipose triglyceride lipase), qui est une enzyme clé initiant la lipolyse des gouttelettes lipidiques cytosoliques (cLD).
- Il apporterait en même temps que CIDEB des tag pour la synthèse des apoB primordiales.

CGI-58/ABHD5 est étudiée dans un chapitre spécifique.
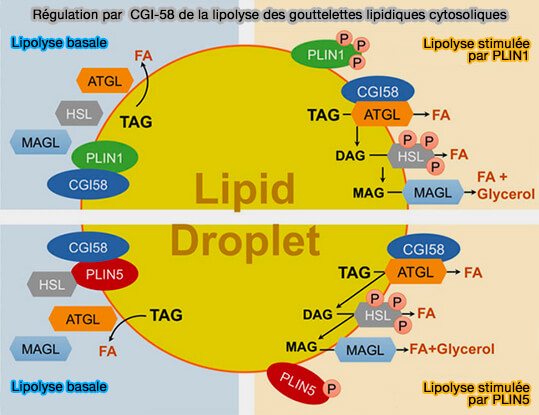
(Figure : vetopsy.fr d'après Yu et Li).
Retour vers la formation de la particule d'apoB primordiale
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


