Métabolisme des lipoprotéines
LPL (LipoProtéine Lipase)
Structure, rôles et GPIHBP1
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La LPL (Lipoprotéine lipase) est le principal effecteur de l'hydrolyse des triglycérides (TG) sur les TRL (lipoprotéines riches en triglycérides), i.e. chylomicrons et VLDL (lipoprotéines de très basse densité).
La LPL est fortement exprimée dans les tissus cruciaux pour l'utilisation et le stockage de l'énergie :
- le cœur,
- les muscles squelettiques,
- le tissu adipeux.
Remarque : d'autres lipases, comme la lipase hépatique (HL) ou la lipase endothéliale (EL) agissent sur d'autres lipoprotéines.
Structure de la LPL
La LPL (Lipoprotéine lipase), EC 3.1.1.34, enzyme synthétisée est synthétisée et sécrétée par les cellules parenchymateuses, principalement les myocytes et les adipocytes.
La quasi-totalité de la LPL dans les tissus se trouve à la surface des cellules endothéliales des capillaires, où elle est liée à GPIHBP1.
1. Le domaine N-terminal (résidus 1–313) est composé de deux domaines.
a. Un pli ou repliement α/β-hydrolase à six hélices α et 10 brins β contient la triade catalytique (Ser132, Asp156, His241), à un seul atome de calcium coordonné par Ala167, Ser172, Asp174 et Asp175, requis pour un repliement correct in vivo (Mammalian alpha beta hydrolase domain (ABHD) proteins: lipid metabolizing enzymes at the interface of cell signaling and energy metabolism 2013).
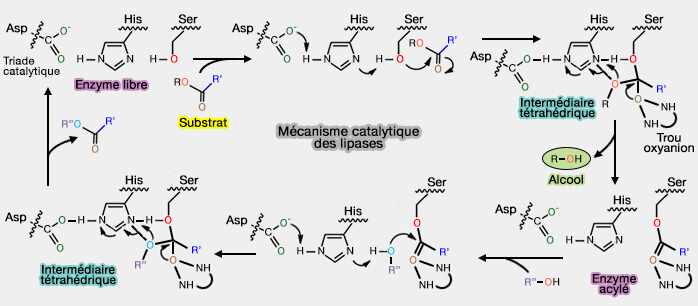
(Figure : vetopsy.fr)
b. Un couvercle (lid, résidues 217–238) comprend un pont disulfure Cys216–Cys239, qui contrôle l'accessibilité du substrat au site actif.
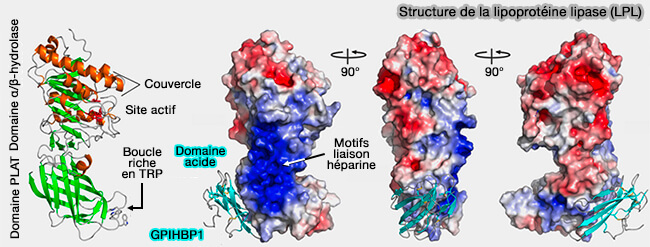
(Figure : vetopsy.fr d'après Kristensen et coll)
2. Le domaine C-terminal contient un repliement en tonneau β à 12 brins β (PLAT, Polycystin-1, Lipoxygenase and Aalpha Toxin) abritant une boucle riche en tryptophane (résidus 387–394) exposée en surface.
Cette boucle riche en résidus aromatiques localisant la LPL sur la membrane, où elle est capturée par SDC1 via la liaison des résidus héparine de LPL, est essentielle pour :
- la séquestration de la LPL sur les HSPG (Heparan Sulfate ProteoGlycan), ,
- le transport,
- la stabilité et la régulation dans les différents compartiments de l'unité intravasculaire,
- l'interaction avec les lipoprotéines et avec le domaine Ly6 de GPIHBP1.
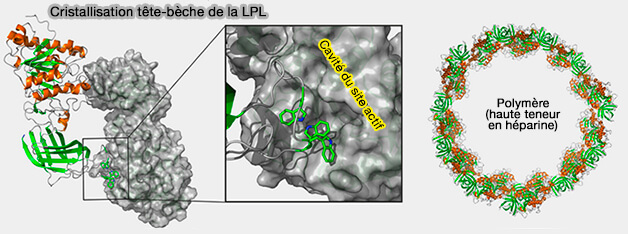
(Figure : vetopsy.fr d'après Kristensen et coll)

LPL est-elle présente et active sous forme de monomère, ou sous forme de dimère tête-queue (Lipoprotein lipase is active as a monome 2019).
Rôle de la LPL
1. La LPL hydrolyse le long de la surface luminale des capillaires les TRL (lipoprotéines riches en triglycérides).
a. Les triglycérides (TG) des chylomicrons et des VLDL (lipoprotéines de très basse densité) sont hydrolysés classiquement par les réactions :
$\ce{Triglycéride + H20}$ $\leftrightharpoons$ $\ce{Diglycéride + acide gras + H^+}$
$\ce{Diglycéride + H20}$ $\leftrightharpoons$ $\ce{Monoglycéride + acide gras + H^+}$
b. Les acides gras non estérifiés obtenus sont alors captés par les tissus périphériques soit pour y être :
- stockés comme dans le tissu adipeux,
- métabolisés dans les muscles striés, le coeur et le cerveau.
(Figure : vetopsy.fr)
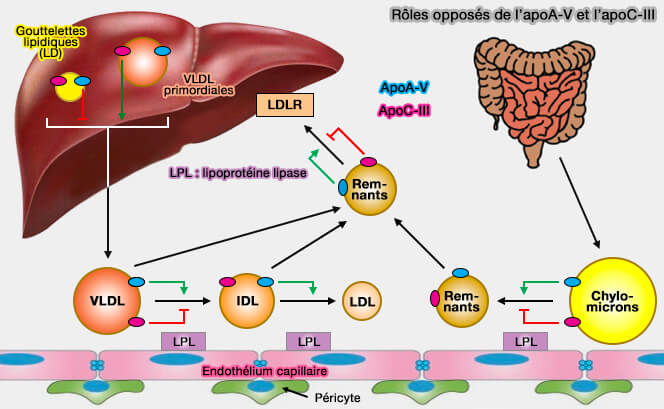
2. La LPL élimine des chylomicrons et des VLDL :
- la majeure partie de leurs triglycérides,
- une partie de leur enveloppe, i.e. phospholipides (PL), cholestérol libre, apoA-I et apoC-II.
Les lipoprotéines résultantes, plus petites, sont alors qualifiées de particules résiduelles ou " remnants ".

Les remnants sont étudiés dans un chapitre spécifique.
(Figure : vetopsy.fr d'après Leth et coll)
3. LPL doit se lier à GPIHBP1, protéine située à la surface des cellules endothéliales (Structure of the lipoprotein lipase–GPIHBP1 complex that mediates plasma triglyceride hydrolysis 2018).
GPIHBP1
Structure de GPIHBP1
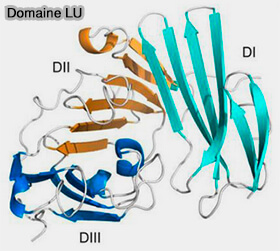
1. GPIHBP1 (GlycosylPhosphatidylInositol anchored High density lipoprotein Binding Protein 1 ou high density lipoprotein-binding protein), protéine de 131 résidus, est membre de la famille des protéines LU ou Ly6 antigen/uPAR (Emerging Role of Lymphocyte Antigen-6 Family of Genes in Cancer and Immune Cells 2019 et Evolution and Medical Significance of LU Domain−Containing Proteins 2019).

GPIHBP1 est exprimée exclusivement dans les cellules endothéliales capillaires dans lesquelles il est présent sur les deux faces.
Il n'est présent ni sur les gros vaisseaux sanguins, ni sur le tissu adipeux, le cœur et les muscles squelettiques.
2. GPIHBP1, membre atypique de cette famille à trois exons, possède un exon supplémentaire codant pour une extension N-terminale acide intrinsèquement désordonnée ou IDR (Intrinsic Disordered Region).
a. Cette extension contient :
- 21 des 26 résidus consécutifs dans GPIHBP1 humain sont de l'aspartate ou du glutamate (The acidic domain of the endothelial membrane protein GPIHBP1 stabilizes lipoprotein lipase activity by preventing unfolding of its catalytic domain 2016),
- une tyrosine sulfatée (Tyr18) qui permet à GPIHBP1. d'augmenter à la fois l'affinité de ces Interactions avec LPL et la capacité de GPIHBP1 de protéger la LPL contre le déploiement catalysé par ANGPTL4 (A disordered acidic domain in GPIHBP1 harboring a sulfated tyrosine regulates lipoprotein lipase 2018).
b. Ce domaine intrinsèquement désordonné peut, par conséquent, atteindre n'importe quelle conformation afin de s'adapter aux patchs chargés positivement de LPL.
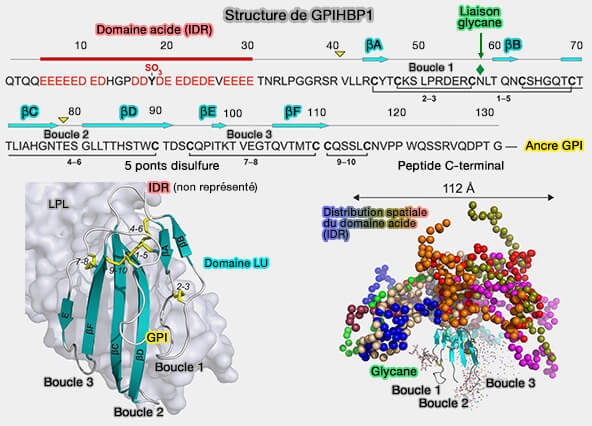
(Figure : vetopsy.fr d'après Kristensen et coll)
2. Son domaine LU (Ly6 antigen/uPAR), de 75 résidus de long, appelé aussi Ly6 par sa similarité avec Ly6 (Lymphocyte Antigen 6), adopte un pli à trois doigts, stabilisé par cinq ponts disulfure, essentiels pour le repliement correct de la protéine (Did evolution create a flexible ligand-binding cavity in the urokinase receptor through deletion of a plesiotypic disulfide bond 2019).
Le domaine LU est indispensable à l'interaction avec la LPL grâce à des forces hydrophobes (Evidence for Two Distinct Binding Sites for Lipoprotein Lipase on Glycosylphosphatidylinositol-anchored High Density Lipoprotein-binding Protein 1 (GPIHBP1) 2015).
3. Son domaine C-terminal se termine par le fragment glycosylphosphatidylinositol, ancre glycolipidique qui lie GPIHBP1 à la membrane (
Interactions de GPIHBP1 avec LPL
Vue d'ensemble
Cette topologie unique permet à GPIHBP1 d'avoir plusieurs rôles (GPIHBP1 and ANGPTL4 Utilize Protein Disorder to Orchestrate Order in Plasma Triglyceride Metabolism and Regulate Compartmentalization of LPL Activity 2021).
- GPIHBP1 se lie rapidement à la LPL.
- Il stabilise la structure de LPL, par son domaine acide, qui empêche le dépliement du domaine α/β-hydrolase de LPL (
rôles des angioprotéines-like).
- Il extrait la LPL liée aux protéoglycanes d'héparane sulfate (HSPG), d'un pool dynamique dans l'espace sous-endothélial (
iChaperonnage de la LPL pendant sa synthèse et sa sécrétion).
En l'absence de GPIHBP1, la LPL reste dans l'espace sous-endothélial (GPIHBP1 Is Responsible for the Entry of Lipoprotein Lipase into Capillaries 2010).
Interactions moléculaires
1. GPIHBP1 a deux interactions distinctes avec la LPL (Structure of the lipoprotein lipase–GPIHBP1 complex that mediates plasma triglyceride hydrolysis 2018) :
- une interaction électrostatique rapide et transitoire entre le domaine acide et les sites de liaison à l'héparine de la LPL,
- une interaction lente et stable entre le domaine LU replié et le domaine PLAT de la LPL.
Les rôles distincts des deux domaines de GPIHBP1 dans l'interaction avec LPL ne sont toujours pas bien définis.
- Le domaine N-terminal agirait comme un " lasso " reliant LPL à GPIHBP1.
- Le domaine LU serait responsable de l'interaction plus forte et plus durable.
En outre, le domaine N-terminal est crucial pour l'interaction de LPL avec GPIHBP1 pendant la lipolyse car la LPL est incapable de se lier aux lipoprotéines attachées au seul domaine LU (Evidence for Two Distinct Binding Sites for Lipoprotein Lipase on Glycosylphosphatidylinositol-anchored High Density Lipoprotein-binding Protein 1 (GPIHBP1) 2015).
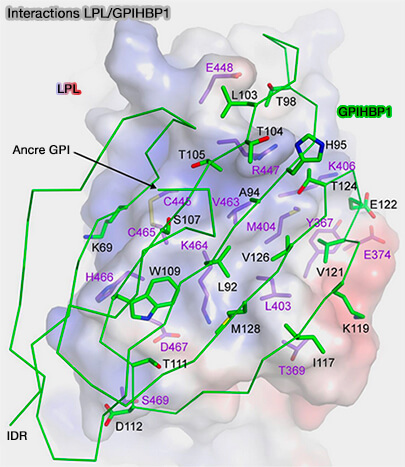
(Figure : vetopsy.fr d'après Birrane et coll)
GPIHBP1 se lie à une seule molécule de LPL et les deux sites de liaison coopèrent pour produire des taux d'association très rapides et des taux de dissociation modérés.

Cette association permet à GPIHBP1 d'extraire la LPL liée à HSPG de l'espace sous-endothélial.
2. Cependant, la cinétique rapide entraîne des interactions transitoires LPL-GPIHBP1 probablement insuffisantes pour une margination stable de grands chylomicrons le long de l'endothélium capillaire, où ils sont soumis à la force pure du flux sanguin.
- 40 à 50 molécules de LPL doivent engager simultanément chaque TRL pour correspondre au taux d'hydrolyse des triglycérides des TRL (lipoprotéines riches en triglycérides).L en solution in vitro.
- Des GPIHBP1 se regroupent dans des microdomaines riches en sphingomyéline de la membrane plasmique des cellules endothéliales capillaires, probablement favorisé par l'ancrage membranaire de GPIHBP1 par son ancre GPI (Glycosylphosphatidylinositol-anchored proteins: Membrane organization and transport 2016).
3. Le domaine acide de GPIHBP1 se lie à un motif de liaison à l'héparine (résidus 279-293) à l'interface entre le domaine hydrolase de LPL et les domaines PLAT (The acidic domain of the endothelial membrane protein GPIHBP1 stabilizes lipoprotein lipase activity by preventing unfolding of its catalytic domain 2016).
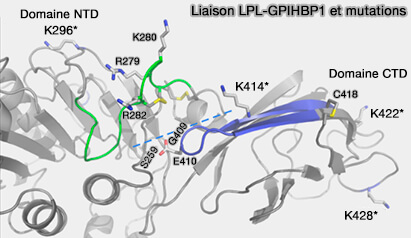
(Figure : vetopsy.fr d'après Mysling et coll)
a. Le domaine acide augmente le taux d'association de GPIHBP1 et LPL de 2500 fois, ce qui permet la transition de LPL d'un état lié à HSPG à un état lié à GPIHBP1 et sa transcytose ultérieure vers la lumière capillaire (A disordered acidic domain in GPIHBP1 harboring a sulfated tyrosine regulates lipoprotein lipase 2018) .
b. Cette région est sujette à des mutations faux-sens provoquant des maladies, i.e. p.Ser259Arg, p.Gly409Arg et p.Glu410Val.
- La troncature de deux résidus (p.Ser447X) de l'extrémité C-terminale de LPL, est associée à des effets bénéfiques dans les études de population.
- Le site de clivage PCSK3 (furine) dans la LPL (résidus 296 à 299) se trouve dans cette région, régulée réciproquement par la liaison d'ANGPTL4 et de GPIHBP1 (ANGPTL4 sensitizes lipoprotein lipase to PCSK3 cleavage by catalyzing its unfolding 2021).
Roles de GPIHBP1 dans le métabolisme des TRL
Du point de vue du métabolisme des triglycérides (TG) plasmatiques chez les mammifères, GPIHBP1 peut être considéré comme le partenaire indispensable pour la LPL (GPIHBP1 and Lipoprotein Lipase, Partners in Plasma Triglyceride Metabolism 2019 et GPIHBP1 and plasma triglyceride metabolism 2016).
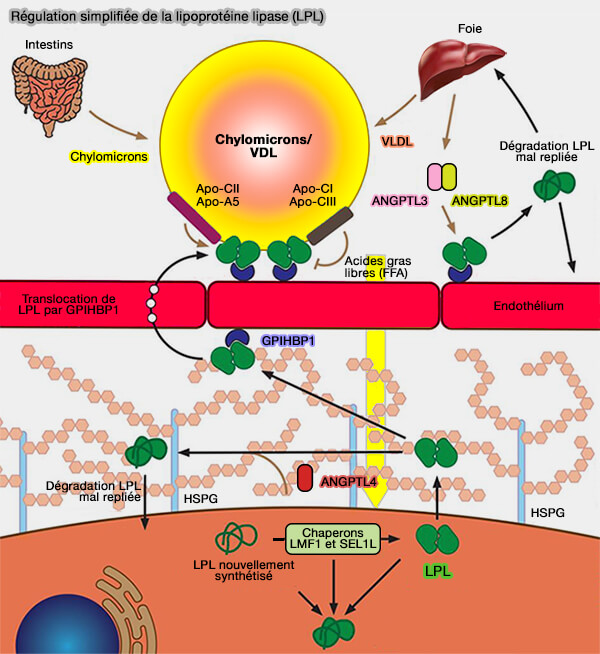
(Figure : vetopsy.fr d'après Kovrov)
1. GPIHBP1 est seul responsable de la capture de la LPL dans les espaces interstitiels et de son transport à travers les cellules endothéliales jusqu'à son site d'action dans la lumière capillaire (GPIHBP1 Is Responsible for the Entry of Lipoprotein Lipase into Capillaries 2010).
En l'absence de GPIHBP1, la LPL reste bloquée dans les espaces interstitiels.
2. Le passage suggère un mécanisme de transport actif vésiculaire qui reste à préciser.
Il existe des quantités considérables de LPL active dans l'espace sous-endothélial, éventuellement liée à GPIHBP1, et prête être transférée de l'autre côté lorsque le besoin s'en fait sentir.
3. La LPL liée à GPIHBP1 est nécessaire pour la liaison des TRL (lipoprotéines riches en triglycérides) le long des capillaires, permettant au traitement lipolytique des TRL de se poursuivre (The GPIHBP1–LPL Complex Is Responsible for the Margination of Triglyceride-Rich Lipoproteins in Capillaries 2014).
En l'absence de GPIHBP1, les TRL ne s'arrêtent pas le long des capillaires et sont emportées dans la circulation sanguine.
Chaperonnage et régulation de la LPL
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


