Lipides
Formation des lipoprotéines : exemple des chylomicrons
3. Formation de la particule apoB primordiale : processus
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Après la digestion des lipides dans la lumière intestinale par les lipases et la résorption des nutriments lipidiques par le pôle apical des entérocytes, ils sont incorporés dans le réticulum endoplasmique (RE).
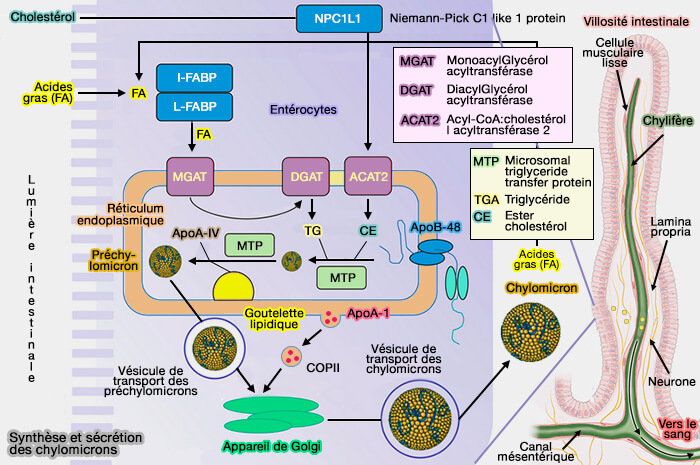
(Figure : vetopsy.fr)
La formation des chylomicrons (CM) et leur passage dans la circulation sanguine est un processus complexe qui, dans vetopsy.fr, a été decoupé arbitrairement en 10 étapes, à savoir :
- 1. le transport des lipides du pôle apical des entérocytes du cytosol à la membrane du réticulum endoplasmique (RE),
- 2. la resynthèse des lipides dans la membrane du RE,
- 3. l'initiation de l'assemblage des lipoprotéines à la membrane du RE, grâce à l'apoB, ici l'apoB-48, pour former des lipoprotéines " primordiales ", ce sera apoB-100 dans le foie,
- 4. la dissociation des lipoprotéines primordiales de la membrane du RE,
- 5. l'extension du coeur des lipoprotéines pour former des préchylomicrons (pré-CM),
- 6. la sortie des préchylomicrons (pré-CM), de la lumière du RE par des vésicules de transport des préchylomicrons (PCTV),
- 7. la livraison des préchylomicrons à l'appareil de Golgi pour former les chylomicrons (CM),
- 8. La sortie des chylomicrons de l'appareil de Golgi par la formation des vésicules de transport des chylomicrons,
- 9. l'exocytose des chylomicrons dans la lamina propria et l'absorption par les chylifères,
- 10. le passage des chylomicrons des chylifères dans la circulation veineuse.
3. Processus d'assemblage de la particule d'apoB primordiale
à la membrane du RE

Ce chapitre du processus d'assemblage suit l'absorption des lipides et précède celui de la formation des chylomicrons dans les entérocytes, mais le processus décrit est à peu près identique à celui la formation des VLDL (lipoprotéines de très basse densité) par les hépatocytes, d'où certaines figures.
ApoB
En raison de la présence de longues séquences hydrophobes dans tous ces domaines, l'apoB-48 peut s'associer aux lipides et peut initier seule l'assemblage des lipoprotéines en interagissant avec la membrane du réticulum endoplasmique (RE).

Les apoB sont étudiées dans un chapitre spécifique, i.e. les B-lps sont les lipoprotéines qui contiennent de l'apoB.
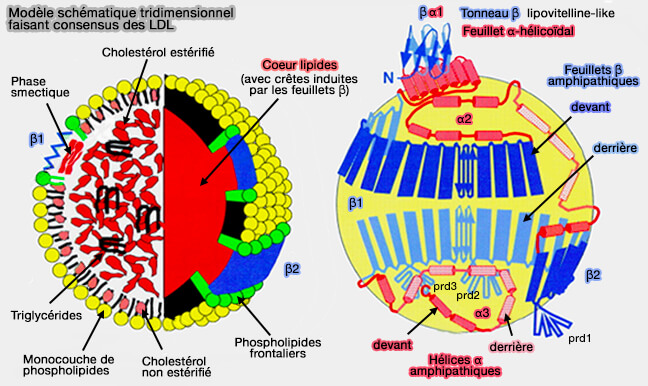
(Figure : vetopsy.fr d'après Segrest et coll)
1. Le domaine βα1 est essentiel pour l'assemblage des B-lps, i.e. sa délétion abolit l'assemblage et la sécrétion des lipoprotéines (The Amino Terminus of Apolipoprotein B Is Necessary but Not Sufficient for Microsomal Triglyceride Transfer Protein Responsiveness 1996).
- Le domaine βα1, pourtant moyennement hydrophobe, interagit avec les lipides de la membrane du réticulum endoplasmique (RE) et pourrait être un premier site de nucléation pour l'assemblage des lipoprotéines.
- Ces sites de nucléation peuvent être stabilisés lorsque des séquences plus hydrophobes sont traduites.
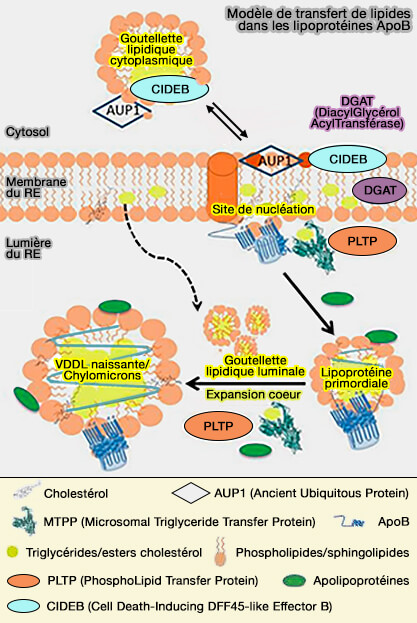
(Figure : vetopsy.fr d'après Sirwi et coll)
2. Les interactions protéine-protéine entre apoB et MTTP (Microsomal Triglyceride Transfer Protein) peuvent générer une poche plus propice à l'acceptation d'un plus grand nombre de lipides (Reconstituting Initial Events during the Assembly of apoB-containing Lipoproteins in a Cell-free System 2008).

MTTP (Microsomal Triglyceride Transfer Protein) est étudiée dans un chapitre spécifique.
Rôles de MTTP
MTTP (Microsomal Triglyceride Transfer Protein) empêche la dégradation de l'apoB et favorise son assemblage en lipoprotéines, et ce, suivant deux processus possibles (Lipid transfer proteins in the assembly of apoB-containing lipoproteins 2018).

Le déficit en MTTP annule l'assemblage et la sécrétion des lipoprotéines.
1. MTTP peut transférer des lipides à l'apoB (
2. Les interactions ioniques entre MTTP et l'extrémité N-terminale de l'apoB sont impliquées dans l'assemblage des lipoprotéines (Apolipoprotein B Binding to Microsomal Triglyceride Transfer Protein Decreases with Increases in Length and Lipidation: Implications in Lipoprotein Biosynthesis 1997).
- Ces interactions sont réduites à mesure que la longueur de l'apoB augmente et qu'elle devient lipidée.
- Ces interactions protéine-protéine pourraient être importantes pour garantir une conformation appropriée nécessaire à la poursuite de la lipidation de l'apoB naissante, sinon on assiste à son repliement incorrect et à sa dégradation (Reconstituting Initial Events during the Assembly of ApoB-containing Lipoproteins in a Cell-free System 2008).
Lipidation des apoB primordiales
1. Les gouttelettes lipidiques en formation dans la membrane du RE des entérocytes et des hépatocytes sont accessibles depuis le lumen (Mature lipid droplets are accessible to ER luminal proteins 2016).
- En l'absence d'apoB, les LD luminales (lLD) s'accumulent dans le réticulum endoplasmique (RE).
- En présence d'apoB, ces lipides sont transférés aux B-lipoprotéines et sécrétés (Chylomicron-sized lipid particles are formed in the setting of apolipoprotein B deficiency 1998).
Remarque : les lipides peuvent aussi provenir des gouttelettes lipidiques cytoplasmiques (cLD).
La composition globale des lLD est identique à celle des cLD quant aux lipides, mais différentes quant aux protéines associées (Lumenal Lipid Metabolism implications for Lipoprotein assembly 2012).
(Figure : vetopsy.fr d'après Lehner et coll)
2. L'apoB naissante au niveau des sites de nucléation peut recevoir des lipides, en particulier dans cette première phase de lipidation, essentiellement :
- des phospholipides (PL),
- des triglycérides (TG).
La deuxième lipidation, i.e. extension du coeur des apoB naissantes, est majoritairement le fait du transfert de TG et d'esters de cholestérol (CE), et les transformera en préchylomicrons.

Tous les acteurs sont étudiés dans des chapitres spécifiques.
Apport de
phospholipides
MTTP et PLTP
L'ajout de phospholipides (PL) à ces sites de nucléation pourrait être suffisant à l'assemblage des B-lps.
1. MTTP transfère les phospholipides (et les triglycérides), i.e. il parait suffisant pour l'assemblage et la sécrétion de lipoprotéines primordiales dans les cellules en culture et dans le foie.
a. La déficience en MTTP provoque l'absence complète de lID (Compensatory Increase in Hepatic Lipogenesis in Mice with Conditional Intestine-specific Mttp Deficiency 2006).
L'inhibition de MTTP dans les cellules dérivées du foie a réduit l'accumulation de gouttelettes luminales sans apoB.
b. Ce processus ne nécessite pas d'interactions protéine-protéine avec l'apoB, car le MTTP purifié peut transférer des lipides entre des vésicules synthétiques qui ne contiennent aucune protéine.
2. La PLTP (PhosphoLipid Transfer Protein) peut également transférer des phospholipides vers les sites de nucléation et aider à prévenir la dégradation de l'apoB étant donné que la déficience en PLTP est associée à un nombre réduit de B-lps.
Cependant, PLTP est incapable de prendre en charge l'assemblage des B-lps en l'absence de MTTP.
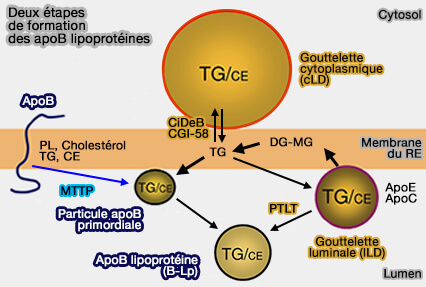
Processus supposé
Le processus supposé pourrait être le suivant.
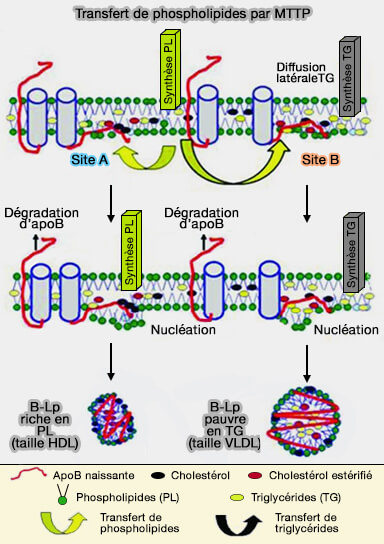
(Figure : vetopsy.fr d'après Khatun et coll)
1. Lors du dépôt de lipides neutres, la surface des B-lps se dilate, nécessitant plus de phospholipides pour couvrir et stabiliser la surface.
Dans ce cas, MTTP et PLTP peuvent transférer plus de phospholipides d'autres sites vers la surface pour soutenir l'assemblage des lipoprotéines.
2. L'activité de transfert de phospholipides (PL) peut amener les molécules de phospholipides à l'apoB naissante et aider à la formation de sites de nucléation (The phospholipid transfer activity of MTP produces apoB-lipoproteins and reduces hepatosteatosis while maintaining low plasma lipids 2012).
a. Le site de nucléation A contient moins de triglycérides (TG), i.e. sa désorption peut produire des particules de taille d'une HDL, i.e. 10 à 20 nm, contenant de l'apoB-48 riche en phospholipides.
b. Au site B, peu de molécules de triglycérides arrivent par diffusion latérale, i.e. la désorption de ce site pourrait entraîner la synthèse de lipoprotéines de d'une VLDL, i.e. 30 à 90nm, contenant de l'apoB-100 ou de l'apoB-48 pauvres en triglycérides.
Apport de triglycérides
Les sites de nucléation peuvent recevoir des triglycérides (TG), principalement par les gouttelettes lipidiques.
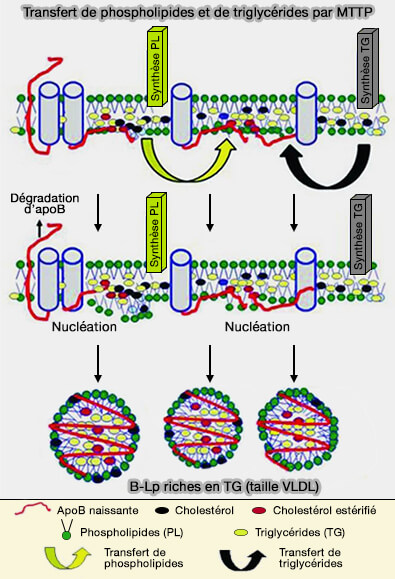
(Figure : vetopsy.fr d'après Khatun et coll)
1. Ce processus dépend de la concentration en TG et il est probable que certaines protéines puissent faciliter cette diffusion latérale.
a. MTTP peut transférer en continu des TG pour accélérer le processus de lipidation de l'apoB.
b. Le transfert des lipides à partir des gouttelettes lipidiques cytoplasmiques (cLD) serait contrôlé par :
- CIDEB (Cell Death-Inducing DFF45-like Effector B,
- AUP1 (Ancient Ubiquitous Protein 1),
- CGI-58 (Comparative gene identification-58), appelé aussi ABHD5 (α/β-hydrolase domain-containing 5).
2. Les sites de nucléation peuvent recevoir des TG à partir de leur site de resynthèse par diffusion latérale au sein de la membrane du réticulum endoplasmique (RE).
- L'activité de transfert de TG peut apporter des lipides neutres créant des sites de nucléation enrichis en triglycérides, lipider l'apoB naissante et inhiber la dégradation protéosomale.
- La désorption de ces sites pourrait produire des apoB-100 et apoB-48 hétérogènes contenant des VLDL de taille différente.

Le transfert de phospholipides (PL) par MTTP et PLTP, des triglycérides (TG) par MTTP et CIDEB est donc essentiel pour l'assemblage des lipoprotéines.
4.5. Formation des préchylomicrons dans le RE
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesFormation des chylomicronsHDL et remodelageTrafic des lipoprotéinesRécepteurs des lipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


