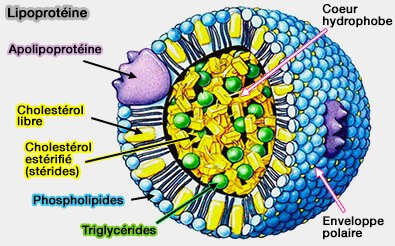
Transport des lipides : lipoprotéines
Apolipoprotéines
Vue d'ensemble
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Vue d'ensemble des lipides
- Acides gras
- Classification des lipides
- Cholestérol
- Glycérides
- Trafic non vésiculaire des lipides et LTP
- Digestion et absorption entérocytaire des lipides
- Lipoprotéines
- Gouttelettes lipidiques
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les apolipoprotéines sont des protéines de liaison aux lipides situées à la surface de particules de lipoprotéines plasmatiques et servent à la fois de composants structurels et de ligands pour diverses protéines et récepteurs.
Dans le métabolisme lipidique, les apolipoprotéines les plus importantes et les plus étudiées sont (Apolipoproteins: metabolic role and clinical biochemistry applications 2011) :
- les apolipoprotéines A (apoA),
- les apoprotéines B (apoB),
- les apoprotéines C (apoC),
- l'apoprotéine E (apoE).
Les apolipoprotéines peuvent s'écrire de différentes manières en abrégé.
1. APO désigne le gène.
2. Puis, on peut trouver diverses formes pour orthographier une apolipoprotéine, i.e. prenons un exemple, ce qui sera plus parlant, l'apolipoprotéine B48 peut s'écrire : apob48, apo b48 ou apo B-48 ou apoB-48, le A de apo peut être écrit avec ou sans majuscule.
Nous l'écrirons dans vetopsy.fr, apoB-48 pour que la recherche soit plus facile dans le site.
Vue d'ensemble des apolipoprotéines
1. Les différentes apolipoprotéines sont regroupées dans le tableau ci-dessous.

Les apolipoprotéines les plus importantes sont étudiées dans des chapitres spécifiques (
(Figure : vetopsy.fr d'après Maceyka et coll)
2. On peut distinguer plusieurs types d'apolipoprotéines
a. Les apolipoprotéines échangeables, i.e. les apoA apoC et apoE, comme leur nom l'indique, sont des protéines présentes en plusieurs copies sur une lipoprotéine et capables de sen dissocier et de se réassocier à une autre lipoprotéine dans la circulation sanguine, en particulier par les HDL ou lipoprotéines de haute densité) (
b. Cette propriété contraste fortement avec l'apoB, non échangeable et retrouvée sur les lipoprotéines excepté les HDL (lipoprotéines de haute densité), i.e. à un seul exemplaire depuis le début de l'assemblage/sécrétion des lipoprotéines jusqu'à la fin de la clairance des remnants, i.e. particules résiduelles des lipoprotéines.

Vous pouvez suivre l'évolution des apolipoprotéines dans : Gain and loss events in the evolution of the apolipoprotein family in vertebrata (2019).
| Apolipoprotéine | Tissu | Distribution | Fonction |
|---|---|---|---|
| Apolipoprotéines A (apoA) | |||
| ApoA-1 |
|
|
|
| ApoA-II |
|
HDL | |
| ApoA-IV |
|
||
| ApoA-V | Foie | ||
| Apolipoprotéines B (apoB) | |||
| ApoB-48 | Intestin | Chylomicrons | |
| ApoB-100 | Foie |
|
|
| Apolipoprotéines C (apoC) | |||
| ApoC-I | Foie | Activateur LCAT |
|
| ApoC-II |
|
Activateur LPL | |
| ApoC-III |
|
||
| ApoC-IV | ? | ||
| Autres apolipoprotéines | |||
| ApoD (apoA-III) |
|
||
| ApoE |
|
||
| ApoF |
|
LDL | Inhibiteur CETP |
| ApoG | Foie | HDL | Ligand des LDLR et LRP |
| Apo(a) | Foie | Lp(a) | Inhibition du plasminogène |
| ApoH (β2-glycoprotéine 1) |
Foie | HDL |
|
| ApoJ (clusterine) |
Foie | HDL | Anti-inflammatoire |
| ApoL | Foie | Neurodéveloppement ? | |
| ApoM |
|
|
|
| Apo-SAA (serum amyloid A) |
Foie | HDL | Phase aiguë inflammation |
|
|||
Structure des apolipoprotéines
Chez l'homme, les gènes des apolipoprotéines ont des structures similaires (Gain and loss events in the evolution of the apolipoprotein family in vertebrata 2019).
Les exons codent pour des peptides signaux, des propeptides et des peptides matures.
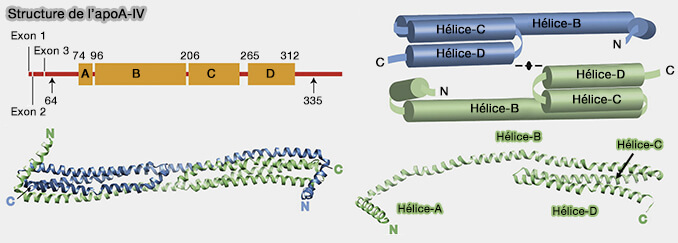
Structure générale
1. Les apolipoprotéines ont un bloc commun de 33 codons et des répétitions variables dans le peptide mature (
Leurs domaines protéiques consistent en :
- une répétition de 33 acides aminés,
- des répétitions de 22 et 11 résidus qui sont des hélices amphipathiques, i.e. appelés aussi 11-mer et 22-mer, mer voulant dire monomère, disposées en tandem et fréquemment ponctuées de résidus de proline.

Les hélices amphipathiques (HA) sont étudiées dans un chapitre spécifique.
(Figure : vetopsy.fr d'après Deng et coll)
2. L'échangeabilité des apolipoprotéines, i.e. apoA, apoC et apoE, est attribuable à cette structure α-hélicoïdale (
- La face liposoluble de l'hélice α amphipathique (HA) interagit avec les parties proximales non polaires des lipides sur la surface de la lipoprotéine.
- Le côté polaire de l'hélice α amphipathique fait face aux molécules d'eau et les groupes de tête phospholipidiques polaires.
a. La relocalisation des apolipoprotéines d'une lipoprotéine à une autre est conditionnée par l'hydrolyse des triglycérides (TG) qui conduit :
- aux modifications de la composition lipidique, i.e. par une affinité variée des HA envers les phospholipides (PL),
- aux modifications de la pression de surface dues à la courbure de la particule qui augmente du fait de la diminution de la taille de la lipoprotéine (
pression de surface),
- aux effets d'encombrement à la surface des lipoprotéines qui se courbe de plus en plus.

Les HDL (lipoprotéines de haute densité) servent de particule de transport et de réservoir pour la plupart des apolipoprotéines échangeables (
b. Ce transfert d'apolipoprotéines entre les lipoprotéines peuvent aussi favoriser la formation de plaques amyloïdes de la maladie d'Alzheimer (D25V apolipoprotein C-III variant causes dominant hereditary systemic amyloidosis and confers cardiovascular protective lipoprotein profile 2016).
Groupes de gènes
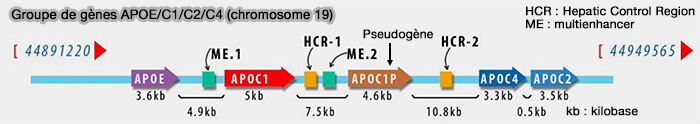
1. Les gènes des apolipoprotéines échangeables humaines sont situées sur trois chromosomes différents (Genetic Regulatory Networks of Apolipoproteins and Associated Medical Risks 2022).
a. Le groupe de gène APOE/C1/C2/C4 est situé sur le chromosome 19q13.32.
(Figure : vetopsy.fr d'après Fuior et coll)
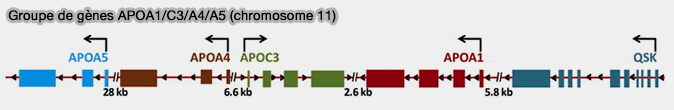
b. Un autre groupe de gènes APOA1/C3/A4/A5 est localisé sur le chromosome 11q23.3,
(Figure : vetopsy.fr d'après Halley et coll)
c. Le gène APOA2 (1,7 kb) est localisé sur le chromosome 1q21-1q23.
2. ApoB et d'autres protéines échangeuses de lipides sont membres d'une super-famille multigène et multispécifique (Apolipophorin II/I, Apolipoprotein B, Vitellogenin, and Microsomal Triglyceride Transfer Protein Genes Are Derived from a Common Ancestor 1999).
Le gène APOB humain est situé sur le chromosome 2 (The apolipoprotein multigene fam structure, structure-function relationships, and evolution 1988).
Rôles des apolipoprotéines
1. Les apolipoprotéines jouent un rôle important dans la structure et la stabilité des lipoprotéines.
2. Elles favorisent le transport des lipides dans les compartiments intravasculaires et extravasculaires.
3. Elles sont responsables des propriétés fonctionnelles des lipoprotéines ainsi que de leur devenir métabolique en étant impliquées :
- dans la synthèse et la sécrétion des lipoprotéines,
- dans la régulation d’enzymes responsables du métabolisme des lipoprotéines.
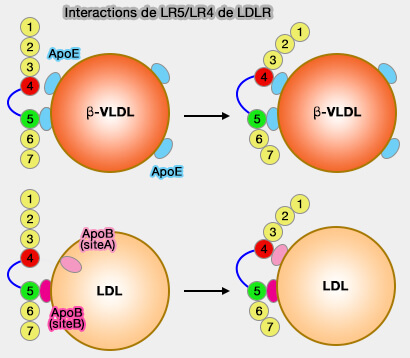
(Figure : vetopsy.fr d'après Martínez-Oliván et coll)
Par exemple :
- l’apoA-1 est l’activateur physiologique de LCAT (Lécithine-Cholestérol AcylTransférase),
- l’apoC-I est inhibitrice de la liaison des LDL (lipoprotéines de basse densité) à leurs récepteurs cellulaires pour leur captation par les cellules.
La liaison de la lipoprotéine à son récepteur s’effectue par :
- l’apoE pour les VLDL,
- l’apoB-100 pour les IDL/LDL et les remnants des TRL (lipoprotéines riches en triglycérides),
- l’apoA-I pour les HDL.

Toutefois, ce nest pas aussi simple. Par exemple, la grande diversité des HDL mnotre aussi des liaison avec l'apoE et l'apoC-III (Apolipoproteins E and CIII interact to regulate HDL metabolism and coronary heart disease risk 2018).
Retour aux lipoprotéines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


