Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Régulation de la lipolyse intracellulaire : CGI-58/ABHD5
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

CGI-58/ABHD5 est un régulateur de la lipolyse intracellulaire par ses interactions avec l'ATGL (Adipose TriGlycéride Lipase) et les pérlilipines (Plin).
Vue d'ensemble de CGI-58/ABHD5
CGI-58/ABHD5 (Comparative gene identification-58 ou α/β-hydrolase domain-containing 5) est un membre d'une grande famille de protéines contenant un pli ou repliement α/β-hydrolase comme HSL (Hormone-Sensitive lipase) ou MGL/MAGL (MonoacylGlycérol Lipase).
CGI-58 est le coactivateur de ATGL (Adipose triglyceride lipase), enzyme initiant la lipolyse des gouttelettes lipidiques cytosoliques (cLD).
Interactions avec les PNPLA
Interactions avec HSL et ATG (PNPLA2)
La liaison de HSL (Hormone-Sensitive lipase) avec CGI-58/ABHD5, l'activateur de l'ATGL (Adipose TriGlycéride Lipase) au niveau des gouttelettes lipidiques cytosoliques (cLD) est essentielle à la régulation de la lipolyse.
1. La région C-terminale de Plin1 est essentielle à la liaison et cette interaction stabilise CGI-58 sur les LD (Human Frame Shift Mutations Affecting the Carboxyl Terminus of Perilipin Increase Lipolysis by Failing to Sequester the Adipose Triglyceride Lipase (ATGL) Coactivator AB-hydrolase-containing 5 (ABHD5) 2011).
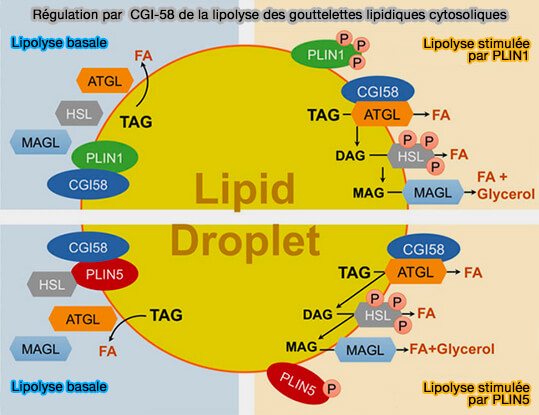
(Figure : vetopsy.fr d'après Yu et Li).
2. CGI-58 se lie également à Plin5, ce qui n'est pas le cas, semble-t-il de Plin2 et Plin3 (Perilipins 2 and 3 lack a carboxy-terminal domain present in perilipin 1 involved in sequestering ABHD5 and suppressing basal lipolysis 2014).
Remarque : CGI-58 apporterait en même temps que CIDEB des tags pour la synthèse des apoB primordiales.
3. CGI-58 de la souris peut être phosphorylé par PKA sur la sérine 239 (CGI-58/ABHD5 is phosphorylated on Ser239 by protein kinase A: control of subcellular localization 2015).
a. La phosphorylation par PKA de CGI-58 améliore sa capacité à recruter, mobiliser et activer l'ATGL phosphorylé, par sa liaison avec la région N-terminale (résidus 1 à 254) de l'ATGL.
b. Néanmoins, CGI-58 reste lié à la surface des cLD via son extrémité N-terminale riche en tryptophane, i.e. Trp-21, Trp-25 et Trp-29 (Structure of a CGI-58 Motif Provides the Molecular Basis of Lipid Droplet Anchoring 2015).
- Pour des variants W21A/W29A, la capacité du CGI-58 à se localiser dans les LD et à activer l'ATGL est complètement abrogée.
- La nature non structurée de l’ancre LD permet une flexibilité conformationnelle et une promiscuité fonctionnelle.
- L'ancre CGI-58 sur les LD est flexible et pourrait subir un changement de conformation pour obtenir une orientation correcte du CGI-58 pour former une plate-forme d'interaction avec l'ATGL, ou pour positionner les triglycérides (TG) favorablement par rapport à l'ATGL lié au CGI-58.
Interactions avec d'autres PNPLA
CGI-58/ABHD5 interagirait également avec d'autres membres de la famille PNPLA.
1. Avec PNPLA1, CGI-58/ABHD5 stimulerait la production de ω-O-acylcéramide dans la peau (ABHD5 stimulates PNPLA1-mediated ω-O-acylceramide biosynthesis essential for a functional skin permeability barrier 2019), ce qui pourrait expliquer le syndrome de Chanarin–Dorfman, syndrome accompagné d'ichthyose (Chanarin-Dorfman Syndrome: A comprehensive review 2021).
(Figure : vetopsy.fr d'après Wang et coll)
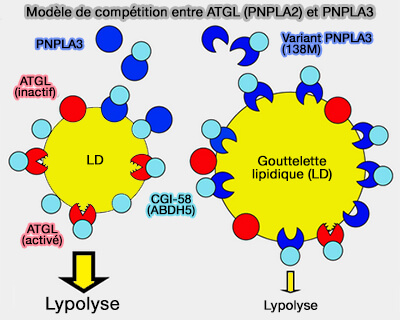
2. Avec PNPLA3 (patatin-like phospholipase domain-containing protein 3), appelée aussi adiponutrine, CGI-58/ABHD5 servirait d’inhibiteur compétitif pour atténuer l’activité catalytique de l’ATGL :
- dans le foie dans lequel son variant (138M) provoque des stéatoses (PNPLA3, CGI-58, and Inhibition of Hepatic Triglyceride Hydrolysis in Mice 2019),
- dans les adipocytes bruns (Dynamic interactions of ABHD5 with PNPLA3 regulate triacylglycerol metabolism in brown adipocytes 2019).
a. Toutefois, le mécanisme, pour l'instant obscur, suggèrerait un mécanisme inconnu qui pourrait être modifié par l’interaction PNPLA3/CGI-58.
- CGI-58/ABHD5 pourrait réguler le renouvellement des LD indépendamment de l'activité lipase de PNPLA3.
- PNPLA3 présenterait une activité lipase ou transacylase envers des substrats spécifiques dans certaines conditions physiopathologiques ou nutritionnelles.
b. La liaison avec CGI-58/ABHD5 est accéléré lors de l'accumulation de LC-CoA (Long-Chain fatty acyl–CoA).
(Figure : vetopsy.fr d'après Li et coll)
3. CGI-58/ABHD5 pourrait aussi interagir avec d'autres membres de la famille des protéines PNPLA pour remplir des fonctions particulières dans des conditions physiopathologiques et nutritionnelles spécifiques.
Autres interactions
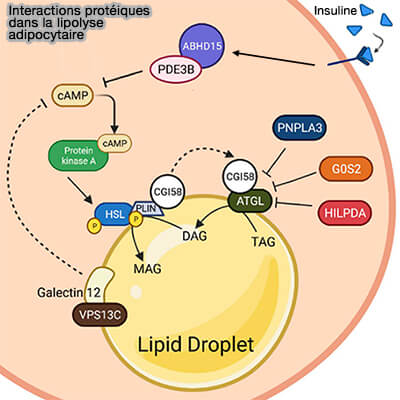
1. La liaison à l'insuline induit la stabilisation de la PDE3B avec CGI-58/ABHD15.
Ce complexe moléculaire favorise la dégradation de l'AMPc, qui inhibe par conséquent la phosphorylation de la HSL lors de l'inactivation de la PKA (Loss of ABHD15 Impairs the Anti-lipolytic Action of Insulin by Altering PDE3B Stability and Contributes to Insulin Resistance 2018).
2. CGI-58/ABHD5 affine l'hydrolyse des triglycérides (TG) stockés dans les LD intracellulaires par un mécanisme de rétroaction du produit final de la lypolyse.
a. CGI-58/ABHD5 interagit avec les FABP ou Fatty Acid Binding Protein (Fatty Acid-binding Proteins Interact with Comparative Gene Identification-58 Linking Lipolysis with Lipid Ligand Shuttling 2015).
Il sert d'accepteur d'acides gras (FA) pour stimuler la lipolyse, i.e. normalement les produits finaux l'inhibent (
b. CGI-58/ABHD5 se lie aussi au LC-Coa (Long-Chain fatty acyl–CoA) ce qui semble favoriser ses interactions avec les Plins pour supprimer la lipolyse (Endogenous and Synthetic ABHD5 Ligands Regulate ABHD5-Perilipin Interactions and Lipolysis in Fat and Muscle 2015).
(Figure : vetopsy.fr d'après Li et coll)
Rôle de sérine protéase
CGI-58/ABHD5 aurait aussi un rôle de sérine protéase qui clive HDAC4 (Histone DésAcétylase 4), i.e. EC 3.5.1.98 dans le cœur en réponse à la stimulation des catécholamines, générant un polypeptide N-terminal de HDAC4 (HDAC4-NT) pour protéger les fonctions cardiaques (The lipid droplet-associated protein ABHD5 protects the heart through proteolysis of HDAC4 2019).
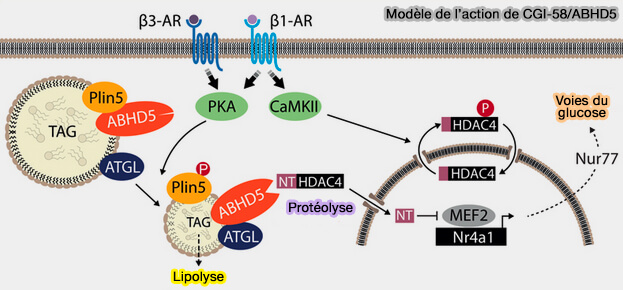
(Figure : vetopsy.fr d'après Jebessa et coll)

CGI-58/ABHD5 aurait une double fonction, i.e. favorisant à la fois la lipolyse et la protéolyse.
Clive-t-il les autres protéines qui interagissent avec lui ? Si oui, cette fonction protéolytique est-elle requise pour que le CGI-58 active la lipolyse LD ? Une lipase nécessite-t-elle un clivage protéolytique avant de digérer une molécule lipidique ? (CGI-58: Versatile Regulator of Intracellular Lipid Droplet Homeostasis 2021).
Retour vers la lipolyse adipocytaire
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation



