Fusion membranaire : protéines SNARE
Protéines R-SNARE : Sec22
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Sec22, R-SNARE, i.e. contenant une arginine (R) dans la couche 0 du motif SNARE, est une t-SNARE (t pour target, cible) impliquée dans le trafic du réticulum endoplasmique (RE) et de l'appareil de Golgi et la fusion vésiculaire, en particulier autophagosome/lysosome.
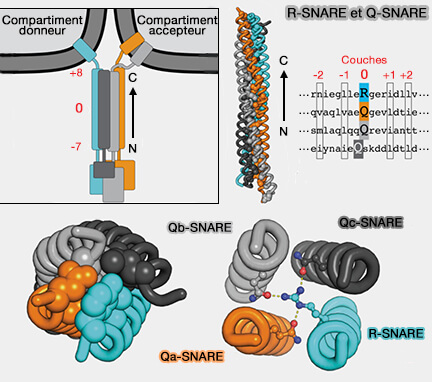
(Figure : vetopsy.fr d'après Baker et coll)
Les R-SNARE comprennent :
- les VAMP (Vesicle-Associated Membrane Protein), formant la majorité des v-SNARE,
- Ykt6 et SEC22B qui font partie de sous-complexes t-SNARE et sont placées comme des Qc-SNARE.
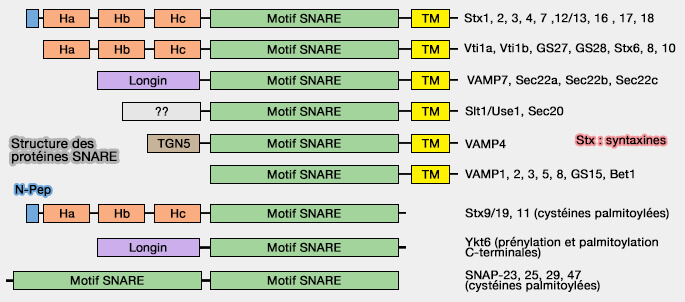
Structure de Sec22
Sec22 de la levure comprend 3 homologues chez les mammifères, i.e. SEC22A, SEC22B et SEC22C, localisées sur les vésicules du réticulum endoplasmique (Diverse Role of SNARE Protein Sec22 in Vesicle Trafficking, Membrane Fusion, and Autophagy 2019).
- Elle joue un rôle majeur pendant le transport antérograde et rétrograde en favorisant une fusion membranaire efficace et en aidant à l'assemblage de complexes d'ordre supérieur par formation d'homodimères.
- Sec22 n'est pas seulement confiné aux compartiments intermédiaires RE-Golgi (ERGIC, i.e. Endoplasmic-Reticulum–Golgi Intermediate Compartment ou VTC, i.e. Vesicular-Tubular Cluster), mais facilite également la formation de sites de contact entre le RE et les membranes plasmiques (
MCS (Membrane Contact Sites) RE/MP).
(Figure : vetopsy.fr d'après Hong et Lev)
1. La structure de Sec22, similaire à celle de VAMP7, comprend :
- un domaine longin, motif coiled-coil N-terminal,
- un domaine SNARE,
- un domaine transmembranaire (TM ou TMD) C-terminal.
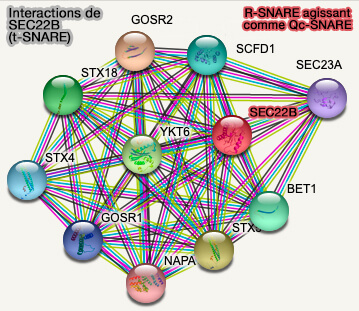
(Figure : vetopsy.fr d'après STRING)
2. Généralement, les protéines Sec22 sont des protéines TA (Tail-Anchored, i.e. ancrée par la queue) avec un seul TMD à l'extrémité C-terminale, tandis que les protéines SEC22 de mammifères peuvent avoir plusieurs TMD (Structure and function of longin SNAREs 2015).
- Le TMD de Sec22 est nécessaire pour une formation efficace d'homodimères qui favorise l'assemblage de complexes SNARE d'ordre supérieur en catalysant la fusion membranaire (Examination of Sec22 Homodimer Formation and Role in SNARE-dependent Membrane Fusion 2015).
- Les isoformes d'épissage avec quatre TMD sont localisées au cis-Golgi, tandis que les isoformes ayant moins de quatre TMD sont localisées dans le réticulum endoplasmique (RE).
Par conséquent, la localisation sous-cellulaire de SEC22 peut être modifiée à la suite de changements dans le nombre de TMD, ce qui affecte finalement sa fonction (The number of the C-terminal transmembrane domains has the potency to specify subcellular localization of Sec22c 2017).
Remarque : Selon les auteurs, soit SEC22b pourrait adopter une conformation fermée susceptible d'être différente de celle de Ykt6 et VAMP7, soit il ne s'auto-inhiberait pas.
Rôles de Sec22
SEC22b, homologue de Sec22 de la levure, intervient dans de nombreux processus (Structure and function of longin SNAREs 2015).
(Figure : vetopsy.fr)
Sécrétion des protéines du RE
Sec22 est impliqué dans la sécrétion des protéines du RE car il forme un complexe avec la protéine résidente du RE USE1 (Slt1).
1. SEC22, comme VAMP7, interviennent dans la sécrétion non conventionnelle (UPS ou Unconventional Protein Secretion) de type III, i.e. qui ne passe pas par l'appareil de Golgi (Role of SNAREs in Unconventional Secretion-Focus on the VAMP7-Dependent Secretion 2022).
2. L'IL-1β et la ferritine, i.e. sécrétion non conventionnelle de protéines sans peptide signal, impliquent SEC22B avec SNAP-23 ou SNAP-29 et les Stx3/Stx4 dans la membrane plasmique.
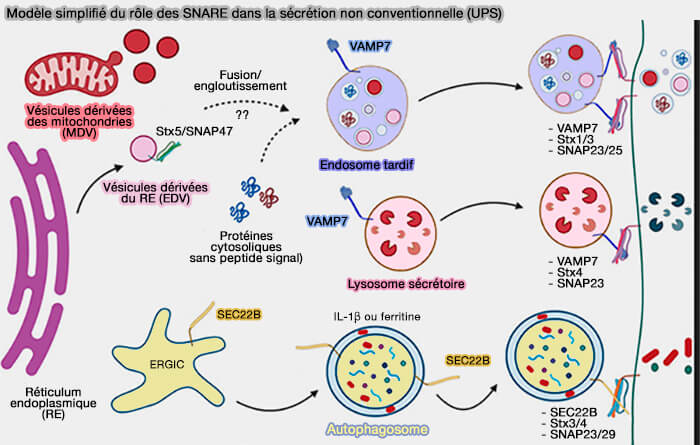
(Figure : vetopsy.fr d'après Vast et Galli)
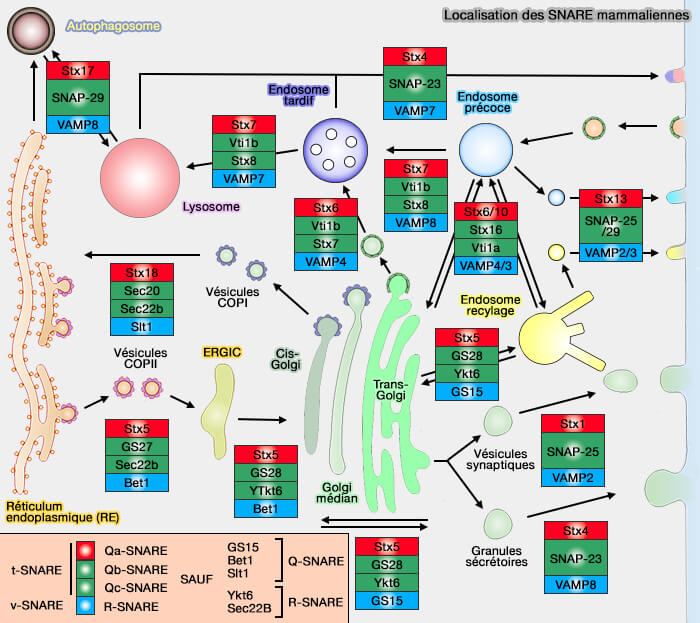
Trafic membranaire entre RE et Golgi
1. SEC22b participe :
- au trafic membranaire antérograde et rétrograde entre le réticulum endoplasmique (RE) et l'appareil de Golgi,
- à la translocation des protéines,
- à la régulation du mouvement cellulaire (Identification of Biomarkers Associated With Alzheimer’s Disease by Bioinformatics Analysis 2016].
La down-régulation de Sec22b dans l'hippocampe est impliquée dans le vieillissement et le cerveau des patients atteints de la maladie d'Alzheimer (Synaptic genes are extensively downregulated across multiple brain regions in normal human aging and Alzheimer’s disease 2013).
2. Le complexe SNARE impliqué dans la fusion des vésicules COPII dérivées du RE vers le Golgi ou l'ERGIC comprend :
- Sec22 comme v-SNARE,
- Stx5-5, Bet1L (GS15) et GS27 (membrine ou GSRO2) comme t-SNARE.
Dans le cas du complexe entre Sec22b et les sous-unités COPII Sec23-Sec24, il ne semble pas que l'hélice α1 et le brin β3 de la région A du domaine longin se lient au domaine coiled-coil (rose), et l'hélice α3 de la région C se lie à l'interface de Sec23 et Sec24.
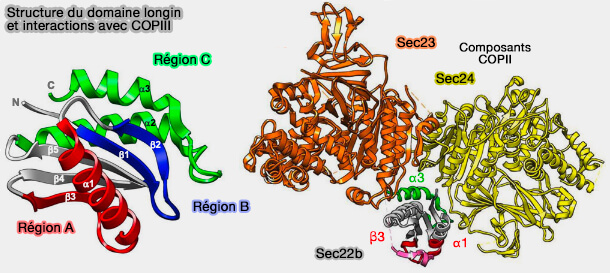
(Figure : vetopsy.fr d'après Daste et coll)
3. La fusion des VTV, i.e. VLDL (lipoprotéines de très basse densité) avec l'appareil de Golgi comprend (The identification of the SNARE complex required for the fusion of VLDL-transport vesicle with hepatic cis-Golgi 2016) :
- Sec22 comme v-SNARE,
- Stx5-5, Bet1L (GS15) et GS28 (GOS-28 ou GOSR1) comme t-SNARE.
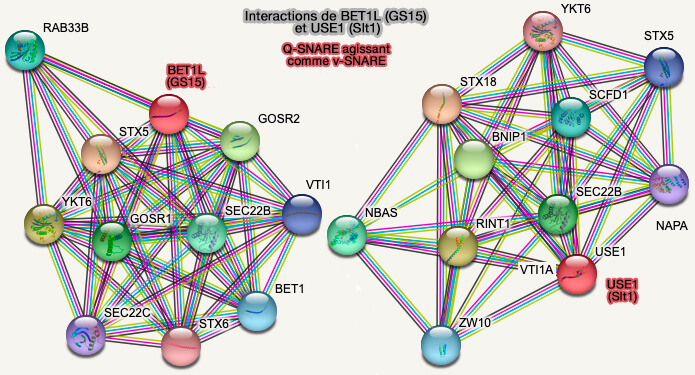
(Figure : vetopsy.fr d'après STRING)
4. Le complexe SNARE impliqué dans la fusion des vésicules COPI dérivées du Golgi comprend :
- Sec22 comme v-SNARE,
- Use1 (Slt1), Sec20 et Stx18/Ufe1 comme t-SNARE.
Stabilisation des MCS (Membrane Contact Sites) RE/MP
SEC22b stabiliserait les MCS (Membrane Contact Sites) RE/MP en rapprochant la membrane plasmique du RE et en interagissant avec la syntaxine-1A (Stx1A).
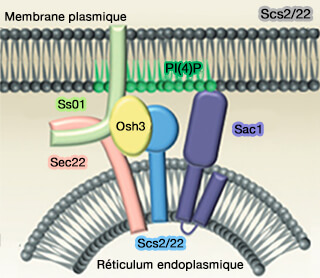
(Figure : vetopsy.fr d'après Petkovic et coll)
1. Sec22 facilite l'échange de lipides entre deux compartiments, indépendamment de tout trafic lipidique vésiculaire.
SEC22b interagit pour cela avec Stx1 de la membrane plasmique (MP) pour rapprocher les membranes du réticulum endoplasmique (RE) et de la MP, mais sans induire leur fusion, car aucun facteur de type SNAP-25 est présent.
-
Chez la levure, Sec22 forme également un complexe avec t-SNARE Sso1, l'homologue de levure de la syntaxine 1A de la membrane plasmique, et les deux protéines interagissent avec les protéines de transfert lipidique Osh2 et Osh3 (
famille ORP/Osh et transfert de lipides).
- Scs22b joue aussi un rôle dans le transfert de PI(4)P au niveau des MCS RE/PM avec Sac1, la phosphatase du RE convertissant PI(4)P en phosphatidylinositol (PtdIns ou PI).
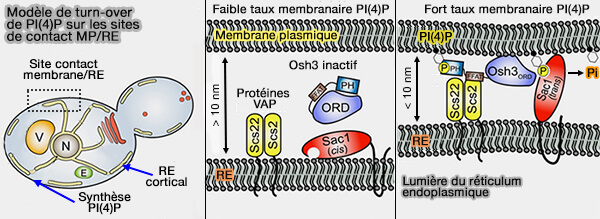
(Figure : vetopsy.fr d'après Stefan et coll)
2. Sec22b a un rôle physiologique au cours du développement neuronal (The SNARE Sec22b has a non-fusogenic function in plasma membrane expansion 2013).
- La surexpression du domaine longin de Sec22b dans les neurones en développement réduit la croissance des neurites.
- Cependant, le rôle exact du domaine longin de Sec22b dans ce processus reste à déterminer.
Biogenèse
Sec22 est impliqué dans les événements de fusion :
- dans la biogenèse des autophagosomes (SNARE Proteins Are Required for Macroautophagy 2012),
- dans la biogenèse des LRO par son interaction avec Vps33B (
complexe CHEVI et rôle dans la biogenèse des LRO).
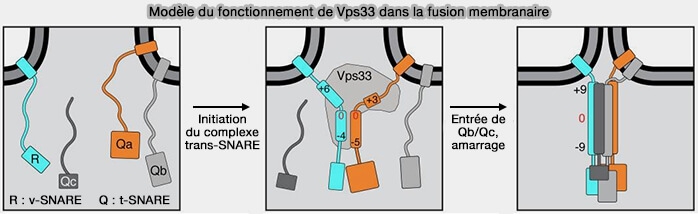
(Figure : vetopsy.fr d'après Baker)
Retour aux R-SNARE
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


