Fusion membranaire : protéines SNARE
Protéines Qb/c-SNARE : SNAP-25
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

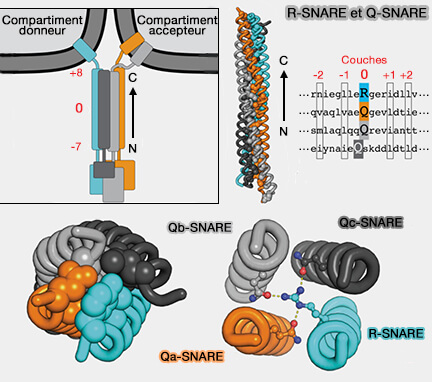
SNAP-25 est une SNAP (Synaptosomal-Associated Protein), Q-SNARE contenant une glutamine (Q) dans la couche 0 du motif SNARE, et en particulier une Qb/c-SNARE, car elle contient deux domaines SNARE.
SNAP-25 fait partie des t-SNARE (t pour target, cible).
(Figure : vetopsy.fr d'après Baker et coll)
Les protéines SNARE forment quatre sous-familles conservées au cours de l'évolution :
- les v-SNARE (v pour vésiculaire), qui sont pour la plupart des R-SNARE,
- les t-SNARE (t pour target, cible) qui sont pour la plupart des Q-SNARE (
infos sur la nomenclature).
Structure de
SNAP-25
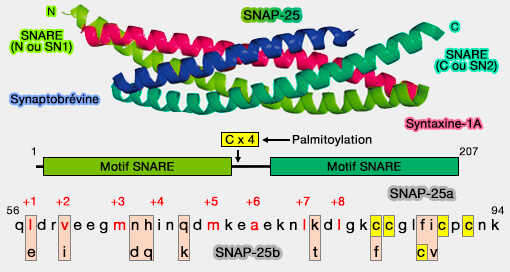
SNAP-25 est une composante du complexe SNARE impliqué dans la fusion vésicule synaptique/membrane plasmique.
Sa structure, composée de 207 résidus, est composée de deux domaines SNARE, reliés par un long lien ou linker (
1. SNAP-25 est présent sous deux isoformes, épissage alternatif de l'exon 5 du gène Snap-25, i.e. SNAP-25a et SNAP-25b.
SNAP-25a et SNAP-25b diffèrent par neuf résidus d'acides aminés, dont un changement de position d'une des quatre cystéines localisées dans le lien entre les deux domaines SNARE et impliquées dans leur palmitoylation pour la fixation membranaire (Alternative Splicing of SNAP-25 Regulates Secretion through Nonconservative Substitutions in the SNARE Domain 2005 et Regional and developmental brain expression patterns of SNAP25 splice variants 2011 et Minor differences in the molecular machinery mediating regulated membrane fusion has major impact on metabolic health 2016).
(Figure : vetopsy.fr d'après Nagy et coll)
2. SNAP-25b est l'isoforme majeure dans les tissus de l'adulte.
3. SNAP-25a est l'isoforme majeure chez l'embryon et participe au développement du tissu neural et ne se retrouve chez l'adulte que dans l'hypophyse et les glandes surrénales.
Rôles de SNAP-25

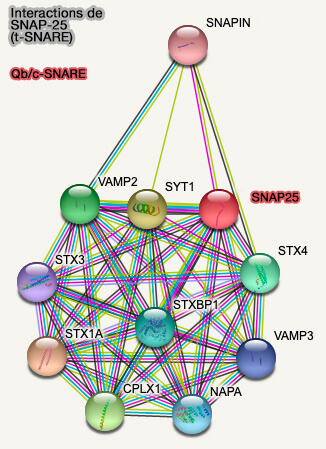
SNAP-25 est un composant du complexe SNARE au cœur de l'exocytose des vésicules synaptiques, i.e. amarrage et fusion aboutissant à la libération des neurotransmetteurs lors de la transmission synaptique. Toutefois, SNAP-25 joue aussi un rôle dans les processus postsynaptiques (SNAP-25, a Known Presynaptic Protein with Emerging Postsynaptic Functions 2016).
Rôles neurologiques
(Figure : vetopsy.fr d'après STRING)
Les principales fonctions, décrites dans un tableau avec la bibliographie respective (
- la libération de neurotransmetteurs,
- la modulation des canaux Ca++ voltage-dépendants (CaV) ou " Voltage-gated calcium channel ", VGCC),
- l'endocytose lente dépendante de la clathrine,
- le trafic des récepteurs postsynaptiques,
- la plasticité à court terme et à long terme,
- la morphogenèse des épines dendritiques,
- la capacité cognitive, l'apprentissage et la mémoire,
- l'excitabilité du réseau et l'activité épileptiforme.
Fusion vésiculaire
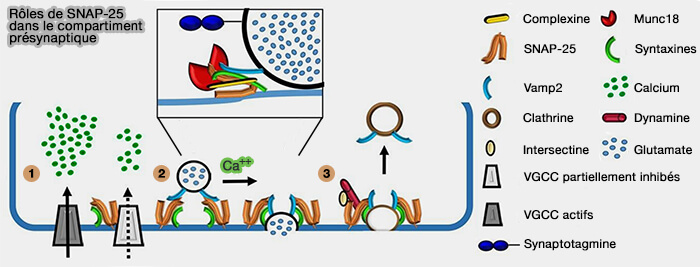
1. SNAP-25 est impliqué dans la machinerie moléculaire médiant la fusion des vésicules déclenchée par Ca++, régulée par la synaptotagmine (
- Le complexe SNARE est composé, outre SNAP-25, de la syntaxine 1 (Stx1) et de la synaptobrévine 2/VAMP2.
- Ce complexe est régulé par les complexines et Munc18, Munc13.
2. SNAP-25 est engagé dans l'endocytose lente des vésicules synaptiques médiée par la clathrine.
- SNAP-25 se lie à l'intersectine, tandis que la syntaxine se lie à la dynamine, une fission des vésicules médiant la GTPase.
- Les interactions entre la synaptobrévine 2/VAMP2 et le domaine ANTH des adaptateurs endocytaires AP180/CALM ont été omises pour plus de clarté.
(Figure : vetopsy.fr d'après Antonucci et coll)
Inhibition de la fusion vésiculaire
1. SNAP-25 se lie avec les canaux calciques CaV (VGCC) pour inhiber l'influx de calcium dans les terminaisons nerveuses.
La suppression du rôle de verrouillage de SNAP-25 se produit lors de la fermeture complète du complexe SNARE, i.e. complexe cis-SNARE, lors de l'afflux élevé de calcium à travers les VGCC (A dual role of SNAP-25 as carrier and guardian of synaptic transmission 2013).
2. L'extrémité C-terminale de SNAP-25 interagit avec la sous-unité Gβγ des protéines G pour inhiber la libération spontanée, i.e. processus modulé par la synaptotagmine-1 (Syt1).
SNP25 et membrane post-synaptique
1. SNAP-25 entre dans l'organisation du réseau de protéines de densité post-synaptique (Reduced SNAP-25 increases PSD-95 mobility and impairs spine morphogenesis 2015).
- SNAP-25 interagit avec p140Cap, i.e. p130Cas-Associated Protein ou SNIP, SNAP-25 Interacting Protein (SNAP-25 regulates spine formation through postsynaptic binding to p140Cap 2013 et Synaptic Interactome Mining Reveals p140Cap as a New Hub for PSD Proteins Involved in Psychiatric and Neurological Disorders 2017).
- p140Cap forme alors un complexe avec PSD95, la cortactine, la protéine de stabilisation des microfilaments d'actine-F, Arp2,3, la protéine de nucléation de l'actine et l'actine-F (Postsynaptic density protein 95 (PSD-95) is transported by KIF5 to dendritic regions 2019).
Les récepteurs NMDA du glutamate sont décrits comme interagissant avec PSD95.
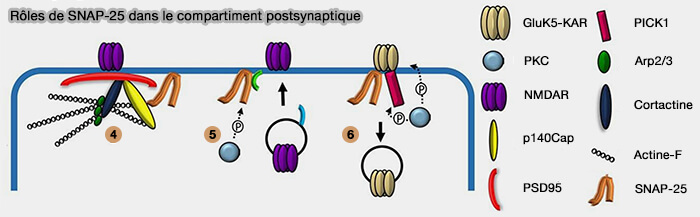
(Figure : vetopsy.fr d'après Antonucci et coll)
2. La phosphorylation de SNAP-25 par PKC (EC 2.7.11.13) favorise l'insertion de canaux NMDA à la surface cellulaire par la délivrance de vésicules post-synaptiques et leur fusion avec la membrane plasmique, éventuellement via la formation d'un complexe SNARE.
3. SNAP-25 est impliqué dans l'élimination des récepteurs kaïnate (KAR) contenant GluK5 comme sous-unité.
- Les KAR s'associent à SNAP-25 et à la protéine PICK1 (protein interacting with C kinase 1).
- La phosphorylation PKC de l'extrémité GluK5-C peut induire un changement conformationnel facilitant l'association avec SNAP-25 et diminuant simultanément l'affinité de liaison GRIP (Glutamate Receptor-Interacting Protein), la protéine à nombreux domaines PDZ ( A Role for SNAP25 in Internalization of Kainate Receptors and Synaptic Plasticity 2009).

Par ce rôle central, SNAP-25 est associée à de multiples troubles psychiatriques, notamment la schizophrénie, le trouble bipolaire et le trouble déficitaire de l'attention/hyperactivité (A Multilevel Functional Study of a SNAP25 At-Risk Variant for Bipolar Disorder and Schizophrenia 2017).
- Le rapport SNAP-25b/SNAP-25a est augmenté chez les patients à trouble bipolaire précoce et à schizophrénie porteurs de l'allèle à risque rs6039769.
-
Connections vmPFC/amygdale
(Figure : vetopsy.fr d'après Taylor)
Remarque : SNAP-25 et SNAP-23 pourraient en partie se remplacer l'un l'autre dans le système nerveux.
- Ils sont préférentiellement et abondamment exprimés de manière présynaptique dans les terminaisons excitatrices positives des transporteurs vésiculaires du glutamate, i.e. VGLUT1 dans l'hippocampe, et VGLUT2 dans le néocortex.
- Il semblerait que les interneurones inhibiteurs hippocampiques et corticaux peuvent exprimer sélectivement SNAP-23.
Rôles métaboliques
SNAP-25 intervient aussi dans les processus métaboliques, i.e. des différences mineures dans la fonction des protéines régulant l'exocytose sont suffisantes pour provoquer (Minor differences in the molecular machinery mediating regulated membrane fusion has major impact on metabolic health 2016) :
- l'hyperglycémie,
- la stéatose hépatique, l'hypertrophie adipocytaire et l'obésité.
(Figure : vetopsy.fr)
SNAP-29, SNAP-23 et SNAP-47
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


