Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
2. Adaptateurs à la clathrine
2a. Adaptateurs classiques
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

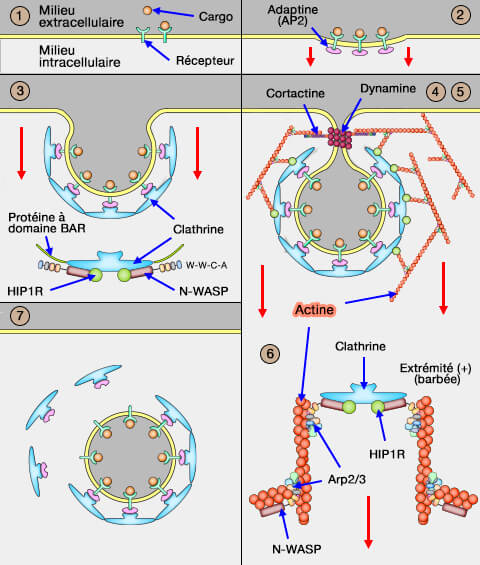
Dans l'endocytose clathrine-dépendante (CME), le récepteur du cargo recrute un complexe adaptateur, car la clathrine ne peut se lier à la membrane.
(Figure : vetopsy.fr)
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
2. Le complexe récepteur-cargo se couple ensuite à une protéine nommée adaptateur à la clathrine, car la cage de clathrine ne peut se lier à la membrane qui comprend :
- a. les adapteurs classiques, i.e. adaptines, CALM et AP80,
- b. les adaptateurs alternatifs,
- c. des protéines à domaines BAR qui se lient à ces adapteurs déforment la membrane pour former une invagination légère, qui va s'approfondir par la suite (
déformation de la membrane).
2. Adaptateurs à la clathrine : vue d'ensemble
Le récepteur recrute un complexe adaptateur pour la clathrine, car elle ne peut se lier à la membrane (Endocytic adaptors – social networking at the plasma membrane 2011).
1. L'augmentation de la composition membranaire en PI(4,5)P2 ou PIP2 est nécessaire pour l’initiation de l’endocytose pour transporter les adaptateurs, en particulier l'AP-2, vers la membrane (The First Five Seconds in the Life of a Clathrin-Coated Pit 2012 et The functions of anionic phospholipids during clathrin-mediated endocytosis site initiation and vesicle formation 2012).
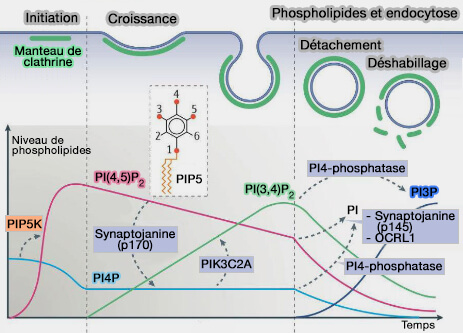
(Figure : vetopsy.fr d'après Kaksonen et Roux)
PI(4,5)P2 est régulé par :
- les phosphatidylinositol phosphates kinases (PIPK) de type I (PIPKI), qui phosphoryle le PI(4)P,
- la synaptojanine, PI 5-phosphatase qui retire le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol des phosphoinositides.
2. La déformation de la membrane par les protéines de la nucléation entre déjà en jeu.
3. On connaît une vingtaine de types d'adaptateurs à la clathrine :
- des adaptateurs classiques comme les adaptines hétérotétramériques,
- des adaptateurs alternatifs monomériques comme les GGA, les epsines ou d'autres.
Remarque : le terme " cargo adaptors " ou protéines CLASP (CLathrin Associated Sorting Proteins ou protéines de tri associées à la clathrine) désigne les protéines qui lient le cargo dans le puits recouvert de clathrine (CCP) et peut désigner les adaptateurs comme les nombreuses protéines accessoires, i.e. AAK1 (AP-2 associated kinase 1), epsine, Eps15, auxiline, β-arrestines, Dab2, synaptojanine, amphiphysine, protéines à domaine BAR, Numb, ubiquitine… (
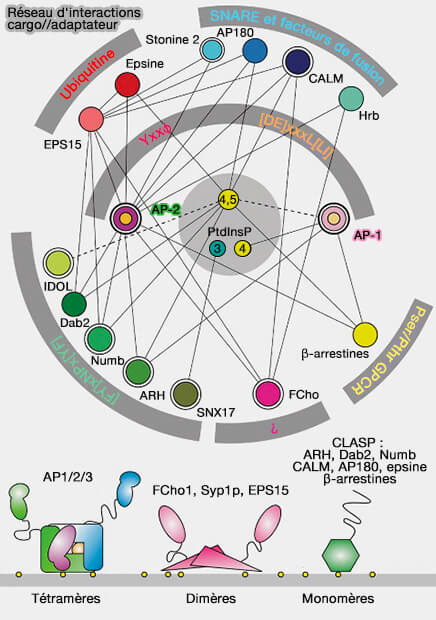
(Figure : vetopsy.fr d'après Traub et Bonifacino)
Attention : les CLASP (CLIP-Associating Proteins) peuvent aussi faire référence à une famille de facteurs de régulation conservés au cours de l'évolution qui contrôlent la dynamique des microtubules et l'organisation de leurs réseaux (CLASPs at a glance 2020).
4. Cependant, il existe aussi des mécanismes pour exclure certains cargos des puits recouvert de clathrine (Clathrin-Coated Pit ou CCP), notamment en lien avec la taille des domaines transmembranaires (Transmembrane domains control exclusion of membrane proteins from clathrin-coated pits 2010).
2a. Adaptateurs
classiques
Adaptines (AP)
Les adaptines (AP - Adaptor Protein - ou PA en français) reconnaissent le récepteur par une séquence particulière de son domaine cytosolique qui est appelée peptide signal par lequel elles se lient à lui.

Les adaptines sont traitées dans des chapitres spéciaux.
1. L'AP-2 est le principal adaptateur de la membrane plasmique impliqué dans la formation de cages de clathrine lors de l'endocytose.
Sa forme peut être représentée grossièrement par la tête de Mickey (Weak Molecular Interactions in Clathrin-Mediated Endocytosis 2017).
Les autres AP, peu différentes (Clathrin-associated adaptor protein complexes 2006), sont localisées dans les endosomes et l'appareil de Golgi. AP-1 et AP-3 sont dépendants de la clathrine.
-
2. La protéine adaptatrice AP-2 est un hétérotétramère constitué de sous-unités α, β2, µ2 et σ2 qui fonctionne comme un adaptateur de la clathrine (
structure de l'AP-2) :
- AP-2 recrute les cargos, via leurs signaux peptidiques, vers les vésicules.
- AP-2 est ainsi capable de reconnaître différents types de signaux via plusieurs de ses sous-unités.
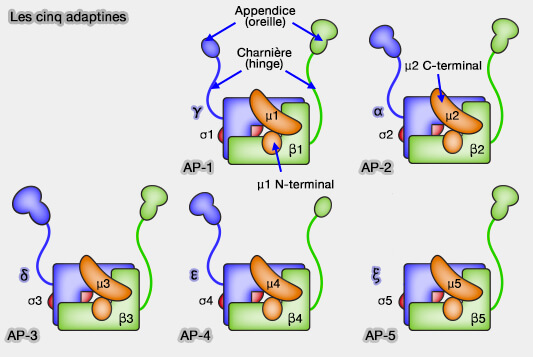
(Figure : vetopsy.fr)
CALM et AP180
Les autres protéines adaptatrices majeures sont CALM et AP180, qui sont également abondantes avec l'AP-2 dans les vésicules de clathrine à raison d'une molécule adaptatrice/triskélion de clathrine (Multivariate proteomic profiling identifies novel accessory proteins of coated vesicles 2012).
1. AP180 et CALM (Clathrin Assembly Lymphoid Leukemia protein) sont des protéines adaptatrices monomères qui se lient à la membrane plasmique via leur domaine ANTH N-terminal et se lient à la clathrine et à AP-2 via un domaine d'assemblage C-terminal (AD) non structuré (A Conserved Clathrin Assembly Motif Essential for Synaptic Vesicle Endocytosis 2000).
-

CALM et AP180
(Figure : vetopsy.fr d'après Moshkanbaryans et coll) - L'AP180 peut recruter la clathrine dans des monocouches lipidiques synthétiques et que l'adaptateur monomère, l'epsine, pourrait assembler un réseau de clathrine et piloter le bourgeonnement des puits recouverts de clathrine (CCP).
2. La maturation des puits recouverts de clathrine nécessite une interaction de AP-2 avec des protéines adaptatrices et accessoires via sa sous-unité α (Advances in Analysis of Low Signal-to-Noise Images Link Dynamin and AP2 to the Functions of an Endocytic Checkpoint 2013).
- La clathrine, les protéines adaptatrices et accessoires se lient aux domaines d'appendice des sous-unités α et β2 avec des affinités différentes.
- D'autres adaptateurs et protéines accessoires avec des domaines BAR (bin-amphiphysin-rvs) sont capables de détecter des lipides de courbure différente et d'induire une courbure (BAR Domain Scaffolds in Dynamin-Mediated Membrane Fission 2014).
- Le domaine N-terminal globulaire de la chaîne lourde de la clathrine possède de multiples sites de liaison pour les protéines adaptatrices, permettant d'influencer la dynamique des fosses recouvertes de clathrine.

(Figure : vetopsy.fr d'après Moshkanbaryans et coll)
3. La détection/induction de la courbure et de l'affinité des lipides pour AP-2 et la clathrine définit la manière dont les protéines adaptatrices et accessoires sont recrutées et localisées spatialement et temporellement pour remplir leur rôle spécifique dans la CME (CALM Regulates Clathrin-Coated Vesicle Size and Maturation by Directly Sensing and Driving Membrane Curvature 2015).
Cette régulation spatio-temporelle doit également garantir que la sélection des marchandises se fasse avant le bourgeonnement.
4. CALM et AP180 garantissent que les VAMP1/2/synaptobrevines soient triés en vésicules naissantes par liaison directe au domaine ANTH (The Molecular Basis for the Endocytosis of Small R-SNAREs by the Clathrin Adaptor CALM 2011 et SNARE motif-mediated sorting of synaptobrevin by the endocytic adaptors clathrin assembly lymphoid myeloid leukemia (CALM) and AP180 at synapses 2011).

CALM et AP180 sont des protéines CME abondantes avec des domaines et des motifs de séquence qui se lient aux lipides, à la cargaison, à AP2 et à la clathrine, ce qui prédit des rôles dans l'initiation, la nucléation des protéines CME, la sélection de la cargaison et l'assemblage de l'enveloppe de clathrine.
GGA (Golgi-localized γ-ear containing Arf binding)
Les trois GGA (Golgi-localized γ-ear containing Arf binding), localisées dans le réseau trans-Golgi (TGN) et les endosomes, ne sont pas incluses dans les adaptines,
Toutefois, leur structure est proche de la sous-unité γ1 de AP-1 et leur rôle est similaire (Regulation of cargo export and sorting at the trans-Golgi network 2019 et Cargo Sorting at the trans-Golgi Network for Shunting into Specific Transport Routes: Role of Arf Small G Proteins and Adaptor Complexes 2019).

Les GGA (Golgi-localized γ-ear containing Arf binding) sont étudiés dans un chapitre spécial.
2b. Adaptateurs alternatifs
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


