Fusion membranaire : chaperons des protéines SNARE
Munc13-1
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Munc13-1 est une protéine essentielle à la fusion des vésicules synaptiques (VS) et à la libération des neurotransmetteurs et à l'amarrage local des vésicules synaptiques (VS) dans les membranes présynaptiques (MP).
Structure des Munc13
Structure de Munc13-1
1. Munc13 (Mammalian uncoordinated-13) est composé par :
- un domaine C1 qui se lie à la membrane,
- trois domaines C2 (C2A, C2B et C2C), qui peuvent se lier au Ca++ et aux membranes,
- un domaine MUN, homologue au domaine de la famille CATCHR (Complexes Associated with Tethering Containing Helical Rods) des complexes d'attache multi-sous-unités ou MTC (The Crystal Structure of a Munc13 C-terminal Module Exhibits a Remarkable Similarity to Vesicle Tethering Factors 2012).
Le domaine MUN, en forme de " banane " selon des données physiques et d'environ 15 nm de long, est divisé en quatre sous-domaines (Syntaxin Opening by the MUN Domain Underlies the Function of Munc13 in Synaptic Vesicle Priming 2015 et Vesicle capture by membrane-bound Munc13-1 requires self-assembly into discrete cluster 2021).
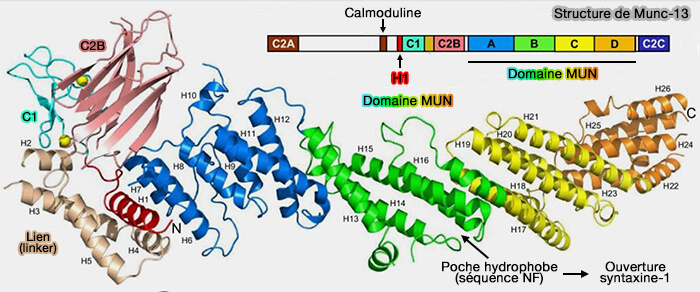
(Figure : vetopsy.fr d'après Xu et coll)
2. La structure C1/C2/BMUN montre que (Mechanistic insights into neurotransmitter release and presynaptic plasticity from the crystal structure of Munc13-1 C1C2BMUN 2017) :
- les domaines C1 et C2B se tassent contre l'extrémité N-terminale du domaine MUN en forme de tige,
- le domaine C2C serait vraisemblablement situé près de l'extrémité C-terminale du domaine MUN.
Structure des autres Munc13
Les protéines Munc13 sont les homologues de Unc-13 de C. elegans et de Dunc-13 de la drosophile et sont classées en trois sous-familles (Definition of Munc13-homology-domains and characterization of a novel ubiquitously expressed Munc13 isoform 2000).
- Les deux classes de Munc13 sont exprimées principalement dans le cerveau.
- La classe de Munc13 court est exprimée principalement dans les organes périphériques.

(Figure : vetopsy.fr d'après Shin et coll)
Vue d'ensemble des fonctions de Munc13-1
Munc13-1 est très abondant dans la zone active (ZA).

(Figure : vetopsy.fr d'après Mochida et Wang)
1. Munc13-1 est impliqué dans l'attache des vésicules synaptiques dans les membranes présynaptiques (MP).
Cette attache locale avant la nucléation des complexes SNARE est nécessaire pour former le pool de vésicules synaptiques prêtes à être libérées (Neurotransmitter Release: The Last Millisecond in the Life of a Synaptic Vesicle 2012).
2. Munc13-1 est essentiel à l'amarrage (docking), à l'amorçage (priming) et à la fusion des vésicules synaptiques (VS) et à la libération des neurotransmetteurs par son implication comme chaperon du complexe SNARE avec les protéines Sec1/Munc18 (SM).

Les protéines SNARE et les protéines Sec1/Munc18 (SM) constituent le moteur moléculaire central qui pilote presque toute la fusion et l'exocytose des membranes intracellulaires.
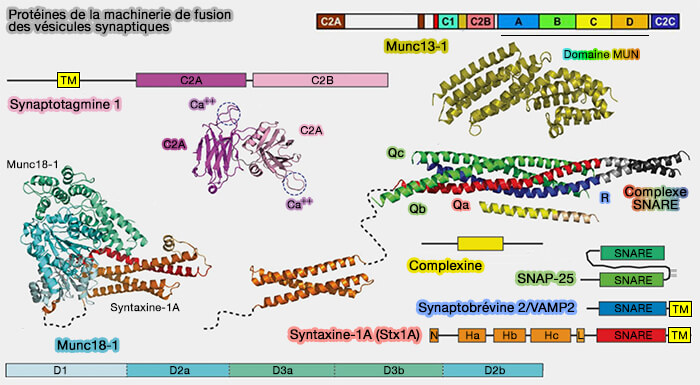
(Figure : vetopsy.fr d'après Jahn et Fasshauer)
Rôle dans l'attache des vésicules synaptiques
Vue d'ensemble
Munc13-1 adopte une topologie " dressée " (Morphologies of synaptic protein membrane fusion interfaces 2017) dans laquelle sa structure en forme de tige montre bien son rôle dans la fixation des vésicules synaptiques à la membrane plasmique (Membrane bridging by Munc13-1 is crucial for neurotransmitter release 2019).

(Figure : vetopsy.fr d'après Quade et coll)
1. Les domaines C1, en se liant au diacylglycérol (DAG), et C2B en se liant à PI(4,5)P2 ou PIP2, s'attachent à la membrane plasmique (Neurotransmitter Release: The Last Millisecond in the Life of a Synaptic Vesicle 2012).
2. Le domaine C2C se lie à la membrane de la vésicule synaptique par la phosphatidylsérine (Functional synergy between the Munc13 C-terminal C1 and C2 domains 2016).
Recrutement de Munc13-1
Munc13-1 et membrane
1. Munc13-1 intrinsèquement cytoplasmique est recruté et regroupé à la surface des membranes plasmiques (The SNAP-25 linker supports fusion intermediates by local lipid interactions 2019 et A C1-C2 Module in Munc13 Inhibits Calcium-Dependent Neurotransmitter Release 2017).
-
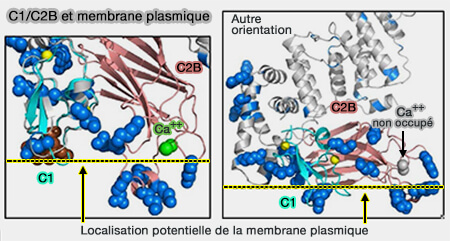
C1/C2b de Munc13-1 et membrane plasmique
(Figure : vetopsy.fr d'après Xu et coll) - La liaison des lipides et du calcium à C1-C2B induit un changement conformationnel qui active sa fonction fusogénique.
a. Des nanogroupes, contenant environ 5-10 molécules Munc13-1, se sont avérés intimement associés aux vésicules synaptiques (VS) au niveau du pool de recyclage des vésicules synaptiques (Synaptic weight set by Munc13-1 supramolecular assemblies 2017).
b. Des nanoclusters éventuellement similaires se forment par auto-assemblage de protomères Munc13-1 (Vesicle capture by discrete self-assembled clusters of membrane-bound Munc13 2020).
2. L'attache membranaire Munc13-1 est régulée par Ca++ (
-
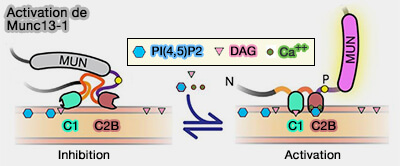
Activation de Munc13-1
(Figure : vetopsy.fr d'après Michelassi et coll) - Dans un deuxième temps, le domaine C2A de Munc13-1 se lie au domaine PDZ de RIM.
Munc13-1 et SNARE isolées
Les clusters Munc13-1 aideraient à concentrer les SNAP-25 (t-SNARE) au niveau du site d'amarrage (docking) membranaire de la vésicule, augmentant ainsi la probabilité de formation productive du complexe SNARE.
- Les vésicules synaptiques (VS) contenant la synaptobrévine 2/VAMP2 s'amarrent aux régions enrichies en PI(4,5)P2 sur la membrane plasmique, guidées par Munc13-1 et la protéine associée aux VS, la synaptotagmine (Synaptotagmin-1 binds to PIP2-containing membrane but not to SNAREs at physiological ionic strength 2015).
- La syntaxine-1 (Stx1) est séquestrée dans ces microdomaines PI(4,5)P2 par des interactions électrostatiques impliquant la région juxta-membranaire de la syntaxine-1 (Phosphatidylinositol 4,5-bisphosphate clusters act as molecular beacons for vesicle recruitment 2013).
Rôle dans l'assemblage du complexe SNARE
Munc18-1 et Munc13-1 coopèrent pour catalyser la nucléation efficace du complexe SNARE.
MUN/complexe SNARE
Munc13-1 se lie, sur des sites distincts de son domaine MUN, à la fois :
- à la syntaxine 1 (Stx1),
- à la synaptobrévine 2/VAMP2.
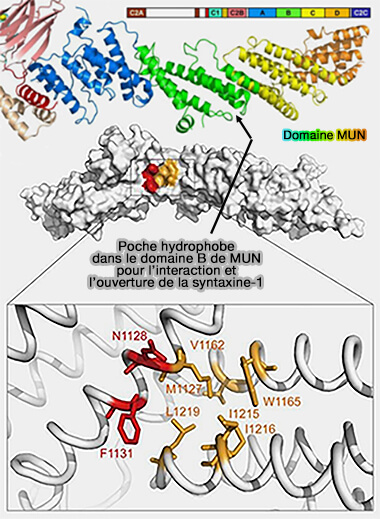
(Figure : vetopsy.fr d'après Yang et coll)
1. Le domaine MUN de Munc13-1 catalyse l'assemblage SNARE à partir des complexes Munc18-1/Stx1 en permettant le passage de Stx1 d'une conformation " fermée " à une conformation " ouverte " (
a. La région centrale de MUN, qui forme une poche hydrophobe contenant une séquence dite NF, se lie à la région de liaison entre le domaine Habc et le domaine SNARE de Stx1 (Conformational change of syntaxin linker region induced by Munc13s initiates SNARE complex formation in synaptic exocytosis 2017).
Cette interaction libère le domaine Hc de la syntaxine du complexe Munc18/syntaxine pour former le complexe ternaire syntaxine-1/SNAP-25/VAMP2 qui favorise la fusion des VS (Munc13 activates the Munc18‐1/syntaxin‐1 complex and enables Munc18‐1 to prime SNARE assembly 2020).
b. La liaison de Ca++/calmoduline à cette région améliorerait la libération en supprimant cette inhibition.
2. La région C-terminale se lie au lien (linker ou LD) juxtamembranaire de Syb2/VAMP2 (Munc18 and Munc13 serve as a functional template to orchestrate neuronal SNARE complex assembly 2019).

Ces liaisons de Munc13 formeraient un complexe dit matrice (template complex), i.e. Munc18-1-Stx1/VAMP2.
3. Le domaine MUM pourrait ainsi :
- orienter leur position, i.e. parallèle au lieu d'antiparallèle, pour un assemblage adéquat (Molecular Mechanisms of Synaptic Vesicle Priming by Munc13 and Munc18 2017).
- accélérer et stabiliser le complexe matrice Munc18-1/Stx1/VAMP2 [(Munc13-1 MUN domain and Munc18-1 cooperatively chaperone SNARE assembly through a tetrameric complex 2020).
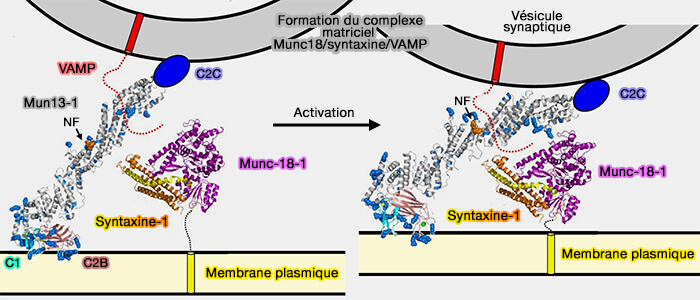
(Figure : vetopsy.fr d'après Xu et coll)
MUN/SNAP-25
Le domaine MUM de Munc13-1 augmente la probabilité de liaison de SNAP-25 au complexe matrice Munc18-1-Stx1/VAMP2 et par la suite complète l'assemblage du complexe ternaire SNARE (Munc13-1 MUN domain and Munc18-1 cooperatively chaperone SNARE assembly through a tetrameric complex 2020).
1. Le domaine MUN de Munc13-1, en plus de lier Stx1 et VAMP2 (
Cette liaison du domaine MUN de Munc13-1 est spécifique du lien (linker) de SNAP-25 qui relie ses deux motifs SNARE.

Munc13-1 peut potentiellement lier les trois SNARE synaptiques simultanément pour les positionner stériquement avec Munc18-1 afin de maximiser le taux de leur assemblage productif en complexe SNARE (Molecular Mechanisms of Synaptic Vesicle Priming by Munc13 and Munc18 2017).
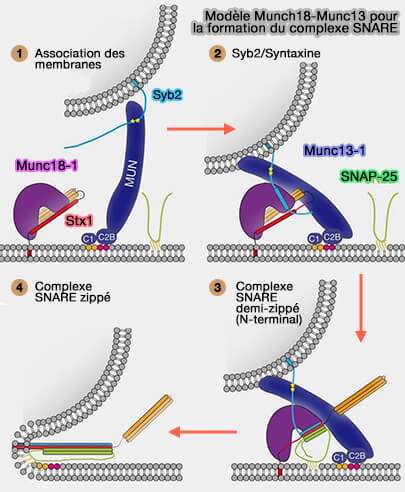
(Figure : vetopsy.fr d'après Wang et coll)
a. Munc13-1 fonctionne alors comme un facteur de connexion pour la capture locale des SV.
La topologie dressée semble incompatible avec le rôle de Munc13-1 dans la catalyse de la nucléation des complexes SNARE, car dans cette configuration étendue, Munc13-1 empêcherait la membrane de se rapprocher et tout complexe SNARE serait intrinsèquement instable lorsque les bicouches impliquées sont séparées de plus de 10 nm (Snapshot of sequential SNARE assembling states between membranes shows that N-terminal transient assembly initializes fusion 2016).
b. Munc13-1 doit donc changer son orientation vers une topologie " plate ", dans laquelle la séparation intermembranaire est réduite à 5 nm (comme observé dans les vésicules prêtes à être libérées dans la zone active), et les complexes SNARE fixés de manière stable à l'état demi-zippé (Symmetrical organization of proteins under docked synaptic vesicles 2019).
- Cette réorientation est probablement entraînée par le réarrangement des domaines C1-C2B sur la membrane plasmique pour pouvoir provoquer une réaction concertée dans laquelle les trois SNARE de deux membranes et les deux chaperons moléculaires peuvent s'aligner favorablement. (Functional synergy between the Munc13 C-terminal C1 and C2 domains 2016).
- Les détails moléculaires précis du passage d'une attache locale à un chaperon SNARE de Munc13-1 sont encore inconnus.
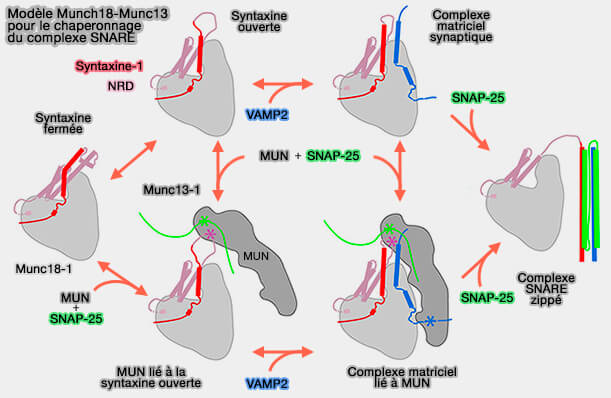
(Figure : vetopsy.fr d'après Zhang et Hugson)

Le rôle principal de MUNC13-1 dans le processus de libération des neurotransmetteurs est de promouvoir l'assemblage des complexes SNARE et de participer à la régulation de l'amarrage (docking) et la fusion des vésicules synaptiques (Tomosyn guides SNARE complex formation in coordination with Munc18 and Munc13 2021).
Mécanisme de fusion
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


