Fusion vésiculaire : chaperons des protéines SNARE
Modèle de chaperonnage Munc18-1/Munc13-1
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les protéines SNARE interagissent avec les protéines SM, i.e. ici Munc18-1, pour former un modèle pour l'assemblage du complexe SNARE catalysé par Munc13-1.
Modèle d'assemblage du complexe SNARE
Vue d'ensemble
Les protéines SNARE interagissent avec les protéines SM, i.e. ici Munc18-1, pour former un modèle pour l'assemblage du complexe SNARE catalysé par Munc13-1.
1. Munc18-1 et Munc13-1 fonctionnent comme des chaperons pour améliorer à la fois la vitesse et la précision de l'assemblage du complexe SNARE.
Pour un historique, voir : Multiple SNARE interactions of an SM protein: Sed5p/Sly1p binding is dispensable for transport (2004), Selective Activation of Cognate SNAREpins by Sec1/Munc18 Proteins (2007), Munc13 Mediates the Transition from the Closed Syntaxin–Munc18 complex to the SNARE complex 2011, Reconstitution of the Vital Functions of Munc18 and Munc13 in Neurotransmitter Release (2013).
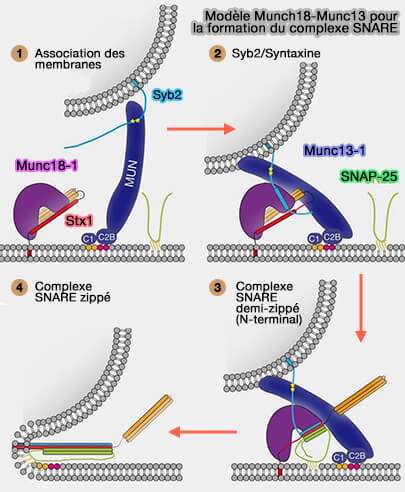
(Figure : vetopsy.fr d'après Wang et coll)
2. Munc13-1 coopère avec Munc18-1 pour chaperonner l'assemblage de SNARE par trois mécanismes :
- passage de la conformation " fermée " de Stx1 à la conformation " ouverte ",
- recrutement des SNARE,
- stabilisation du complexe.
Modèle supposé
1. Munc18-1 se lie et stabilise la syntaxine-1 dans une conformation " fermée ", i.e. Stx1 est localisée dans la cavité arquée de Munc18-1, avec le domaine Habc replié sur la moitié N-terminale (NTD) du motif SNARE (
2. Munc13-1 ouvre Stx1 lié à Munc18-1 par son domaine MUM.
La région centrale de MUM, par sa séquence NF, se lie à la région de liaison entre le domaine Habc et le domaine SNARE de Stx1, exposant le domaine SNARE de la syntaxine-1 pour l'initiation de l'assemblage SNARE (
- La structure de la syntaxine-1 inconnue pourrait ressembler à celle de la Tlg2 ouverte liée à Vps45 (
complexe Vps45/Tlg2).
- L'ouverture de la syntaxine-1 liée à Munc18-1 implique un apport d'énergie relativement faible, qui peut être fourni par la faible liaison de Munc13-1 à la région de liaison de la syntaxine-1.
3. En même temps, Mun13-1 se lie par son domaine MUN à VAMP2 pour stabiliser le complexe matriciel Munc18-1/Stx1/VAMP2.
La liaison de Stx1 et de VAMP2, permettant un alignement correct des deux SNARE, s'effectue en coopération avec :
- Munc13-1, par son domaine MUM (
domaine MUN),
- Munc18-1 par son épingle à cheveux hélicoïdale (
complexe Munc18-1/VAMP2).
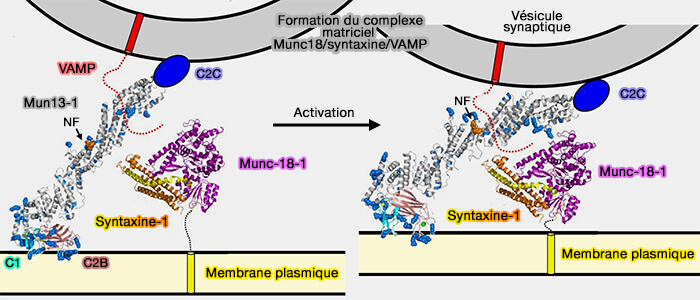
(Figure : vetopsy.fr d'après Xu et coll)
Les NTD des domaines SNARE de Stx1 et VAMP2 alignées de manière adéquate sur l'épingle à cheveux hélicoïdale de Munc18-1 nucléent l'assemblage.
- Les sites de liaison CTD divergents des domaines SNARE garantissent que la fermeture éclair CTD affaiblit les interactions entre les composants du complexe de matrice pour favoriser leur libération.
- De plus, les interactions étendues entre les protéines SNARE, Munc18-1 et Mun13-1, ainsi que les interactions entre les deux SNARE, leur confèrent une spécificité, inhibant l'assemblage de SNARE non apparentés ou antiparallèles.
(Figure : vetopsy.fr d'après Zhang et Hugson)
4. Une fois le complexe matrice Munc18-1/Stx1/VAMP2 formé, SNAP-25 peut se lier rapidement pour former le complexe SNARE (Munc18-1 catalyzes neuronal SNARE assembly by templating SNARE association 2018).
- Le domaine MUM de Munc13-1 se lie au lien entre les deux domaines SNARE de SNAP-25 (
complexe Munc13-1/SNAP-25).
- Il accélère et stabilise ainsi le complexe de matrice Munc18/Syntaxine-1/VAMP2, et prend ainsi en charge une liaison SNAP-25 efficace (Munc13-1 MUN domain and Munc18-1 cooperatively chaperone SNARE assembly through a tetrameric complex 2020).
- La fermeture éclair est à demi-zippée comme précédemment pour le domaine matriciel.
5. La fermeture éclair se zippe entièrement pour la fusion membranaire.
Remarque : d'autres facteurs tels que la synaptotagmine ciblent le complexe SNARE demi-zippé pour permettre une fermeture à glissière SNARE supplémentaire déclenchée par le calcium et la fusion des vésicules.
6. Une fois l'assemblage SNARE terminé, Munc18-1 se dissocie probablement du faisceau à quatre hélices SNARE.
Autres modèles
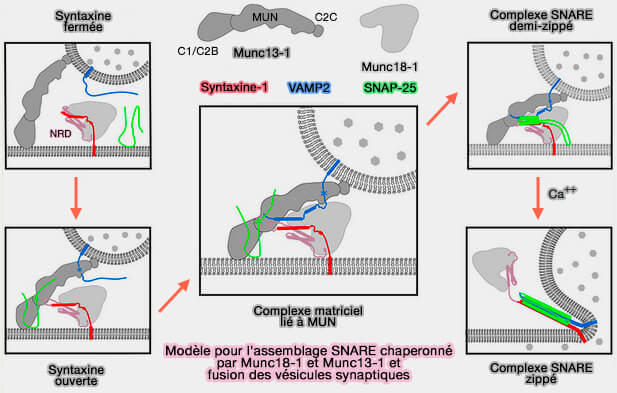
D'autres modèles existent avec quelques variantes (Munc18-1 induces conformational changes of syntaxin-1 in multiple intermediates for SNARE assembly 2020).
1. Lorsque STX1 se retrouve en conformation " ouverte " après l'intervention de Munc13-1 sur le complexe Munc18/syntaxine-1, STX1 pourrait se lier à SNAP-25 directement pour former un complexe t-SNARE Stx1/SNAP-25 ou un complexe Munc18-1/syntaxine/SNAP-25.
- Dans le complexe ternaire dans un stade intermédiaire (4 de la figure ci-dessous), i.e. Munc18-1, Stx1, SNAP-25, Stx1 est vérrouillée dans la cavité de Munc18-1, i.e elle est résistante à l'action de NSF-SNAP (Autoinhibition of Munc18-1 modulates synaptobrevin binding and helps to enable Munc13-dependent regulation of membrane fusion 2017).
- Le complexe ternaire servirait alors de chaperon pour l'interaction avec la v-SNARE, i.e. la synaptobrévine 2/VAMP2.
2. Lorsque le complexe ternaire est ouvert par Munc13-1, un complexe SNARE entièrement assemblé peut se former.

(Figure : vetopsy.fr d'après Lee et coll)
Complexes d'attache multi-sous-unités
Le contact initial réversible entre une vésicule et sa membrane cible est contrôlé par les complexes d'attache à multi-sous-unités, i.e. MTC ou Multisubunit Tethering Complexes (Tethering the assembly of SNARE complexes 2013 et Chaperoning SNARE assembly and disassembly 2016 et Structure of membrane tethers and their role in fusion 2019).

Les complexes d'attache sont étudiés dans des chapitres spéciaux.
1. Pour les vésicules synaptiques, Munc13-1 joue ce rôle par son domaine MUN.
2. Dans la plupart des autres voies de trafic, l'attache nécessite un MTC.
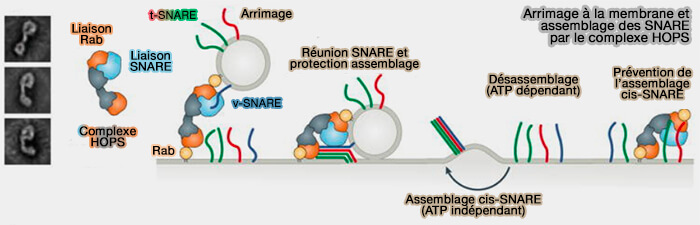
(Figure : vetopsy.fr d'après Baker et Hugson)
L'activité d'assemblage SNARE des complexes endo-lysosomaux Vps de classe C, i.e. complexe CORVET des endosomes précoces et complexe HOPS des endosomes tardifs, repose en partie sur la protéine SM Vps33, qui est une sous-unité intégrale du complexe (Crystal structures of the Sec1/Munc18 (SM) protein Vps33, alone and bound to the homotypic fusion and vacuolar protein sorting (HOPS) subunit Vps16 2013).
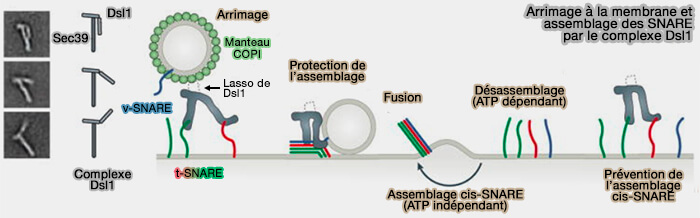
(Figure : vetopsy.fr d'après Baker et Hugson)
Les MTC de la famille CATCHR et les protéines SM interagissent aussi directement (Direct interaction between the COG complex and the SM protein, Sly1, is required for Golgi SNARE pairing 2009, Regulation of exocytosis by the exocyst subunit Sec6 and the SM protein Sec1 2012).
3. De plus, les MTC semblent avoir des rôles indépendants du SM dans l'assemblage SNARE, comme il est montré dans les exemples qui suivent.
- Le complexe Dsl1 de la famille CATCHR lie les Qb- et Qc-SNARE via leurs domaines Habc, les maintenant à proximité et les empêchant de former des conformations fermées (Structural basis for the binding of SNAREs to the multisubunit tethering complex Dsl1 2020).
- Le complexe exocyste de la famille CATCHR se lie au Qa-SNARE Sso2 de telle sorte qu'il desserre sa conformation autrement étroitement fermée (Sec3 promotes the initial binary t-SNARE complex assembly and membrane fusion 2017).

Plusieurs questions restent en suspens !
- De quelle manière les MTC et les protéines SM collaborent pour coupler la fixation des vésicules à un assemblage SNARE efficace et à la fusion membranaire ?
- Contrôlent-ils la qualité des assemblages pour s'assurer que la fusion ultérieure des vésicules se produise au bon moment et au bon endroit ?
- Sont-ils nécessaires pour fournir une force supplémentaire afin d'aider les protéines SNARE à fusionner les membranes ? Ou les deux ?
Autres régulations : complexine et synaptotagmine
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


