Fusion membranaire : protéines SNARE
Régulation des protéines SNARE
Synaptotagmines : vue d'ensemble
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Les synaptotagmines (Syt) sont une famille évolutive conservée de protéines dans le trafic membranaire qui, pour leur grande majorité, sont des capteurs de Ca++ engagés dans la libération des neurotransmetteurs.
Avec les complexines, elles constituent une classe de régulateurs des protéines SNARE qui sont particulièrement importants dans les événements de fusion des vésicules synaptiques (VS) déclenchés par le calcium (
Ces régulateurs ne sont pas nécessaires à la fusion en soi, mais ils permettent l'accumulation, au niveau de la membrane plasmique, d'une réserve (pool) de vésicules prêtes à fusionner en attente du signal, i.e. entrée de calcium pour une libération synchrone.
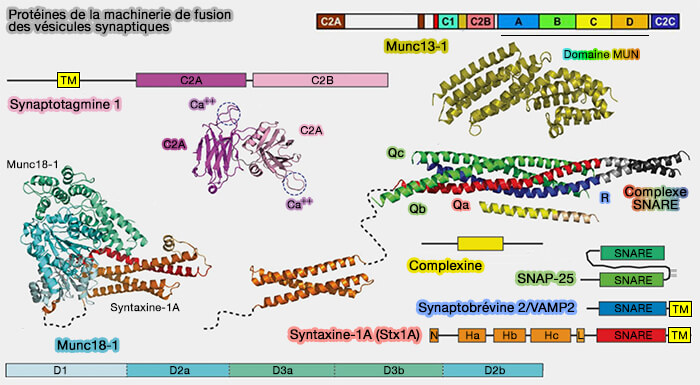
(Figure : vetopsy.fr d'après Jahn et Fasshauer)
Classification des synaptotagmines
Les synaptotagmines (Syt) sont une famille évolutive conservée de protéines dans le trafic membranaire qui, pour leur grande majorité, sont des capteurs de Ca++ engagés dans la libération synchrone rapide de neurotransmetteurs (Distinct Initial SNARE Configurations Underlying the Diversity of Exocytosis 2012).
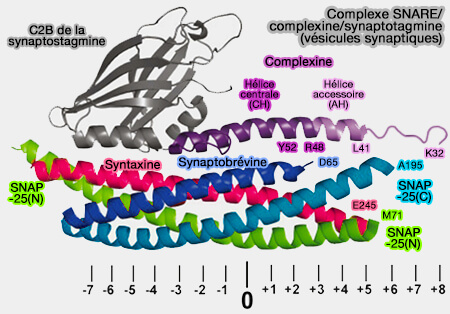
(Figure : vetopsy.fr)
On compte 17 isoformes de synaptotagmines, Syt1 à 17, dont la plus étudiée est la Syt1.
Voir : Axonal and dendritic synaptotagmin isoforms revealed by a pHluorin-syt functional screen (2012) et Differential mRNA expression patterns of the synaptotagmin gene family in the rodent brain (2009) et Evolutionary genomics of plant genes encoding N-terminal-TM-C2 domain proteins and the similar FAM62 genes and synaptotagmin genes of metazoans (2007).

Une bonne bibliographie des synaptotagmines se trouve dans : SNARE Regulatory Proteins in Synaptic Vesicle Fusion and Recycling (2021).
Syt1
1. La synaptotagmine-1 (Syt1), ancrée dans les membranes vésiculaires, assure la médiation de l'exocytose évoquée synchrone (ou rapide) Ca++-dépendante des vésicules synaptiques (VS) dans les jonctions neuromusculaires et les neurones de l'hippocampe, et des LDCV (grandes vésicules centrales denses) dans les cellules chromaffines de la médullosurrénale.
- Les neurotransmetteurs contenus dans les vésicules synaptiques sont libérés en réponse à l'influx de Ca++ au niveau des terminaisons nerveuses présynaptiques suite à l'arrivée d'un potentiel d'action.
- La transmission au niveau des synapses est rapide, i.e. 0,2 à 1 ms.
- La fusion des vésicules se produit dans les 10 à 100 μs après l'influx de Ca++.

Cela permet un transfert d'informations rapide et précis de neurone à neurone au moyen de la transmission synaptique et de la libération de médiateurs phasiques.
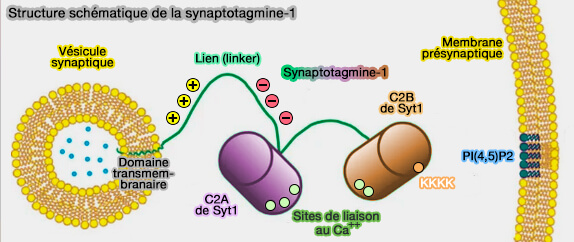
(Figure : vetopsy.fr d'après Lin et coll)
2. Syt1 n'intervient pas dans la libération asynchrone (AR ou Asynchronous Release), i.e. d'autres capteurs de Ca++ sont impliqués (The Ever-Growing Puzzle of Asynchronous Release 2019).
- Dans certaines synapses, un seul ou une courte rafale de potentiels d'action peuvent générer une libération synaptique retardée ou asynchrone d'une durée de plusieurs dizaines ou centaines de millisecondes.
- L'AR permet de recruter des récepteurs métabotropes extrasynaptiques et de maintenir un niveau élevé de neurotransmetteur dans l'espace extracellulaire pendant une période de temps sensiblement plus longue après l'activité présynaptique.
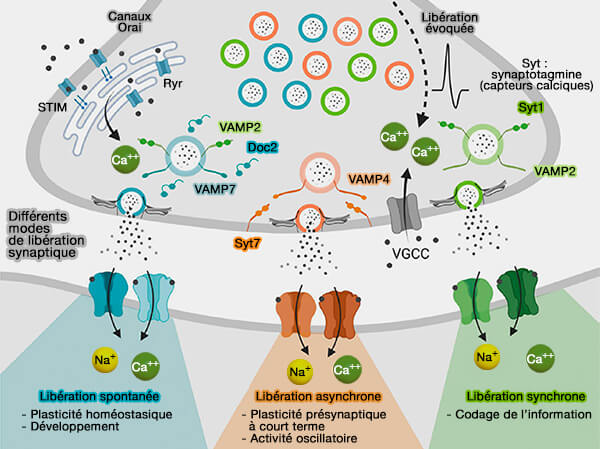
(Figure : vetopsy.fr d'après Guzikowski et Kavalali)
Autres synaptotagmines
1. Syt2 et Syt9 sont impliquées dans la libération synchrone de neurotransmetteurs déclenchée par Ca++ pour différents sous-ensembles de neurones.
| Localisation des synaptotagmines (Syt) | ||||
|---|---|---|---|---|
| Système nerveux |
Ailleurs que cerveau |
??? | ||
| Axones | Dendrites | Les deux | ||
| Syt1 (VS et LDCV) |
Syt3 | Syt4 | Syt10 | Syt8 |
| Syt2 (VS) | Syt11 | Syt6 | Syt14 | |
| Syt5 | Syt9 (VS) | Syt15 | ||
| Syt7 (LDCV) | Syt12 | |||
| Syt17 | ||||
Par exemple, Syt9 est localisée dans le système limbique et le striatum (Synaptotagmin-1, -2, and -9: Ca2+ Sensors for Fast Release that Specify Distinct Presynaptic Properties in Subsets of Neurons Author links open overlay panel 2007).
2. Syt3 est impliquée dans l'amarrage (docking) des vésicules synaptiques (VS).
3. Syt7, localisée sur la membrane présynaptique, assure la libération asynchrone, mais a bien d'autres fonctions liées au Ca++.

Syt7, par son importance, est étudiée dans un chapitre spécial.
4. Syt11, substrat physiologique de la parkine, et joue un rôle critique dans la médiation de sa neurotoxicité en altérant la libération de dopamine dans la substantia nigra pars compacta (SNPC), en inhibant l'endocytose dans la maladie de Parkinson récessive autosomique de type PD (Synaptotagmin-11 is a critical mediator of parkin-linked neurotoxicity and Parkinson’s disease-like pathology 2018).
Remarque : des protéines de type synaptotagmine, appelées extended synaptotagmines (E-Syt1-3) et tricalbines (Tcb1-3) chez la levure, régulent la formation des sites de contact membranaire (MCS) entre le réticulum endoplasmique (RE) et la membrane plasmique pour le transfert des lipides.
Structure des synaptotagmines
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


