Fusion membranaire : protéines SNARE
Protéines R-SNARE : Ykt6
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Fusion membranaire
- Vue d'ensemble de la fusion membranaire
- Machinerie de fusion
- Mécanisme de fusion membranaire
- Fusion des différents compartiments membranaires
- Fission membranaire
- Fusion membranaire
- Endocytose
- Voie sécrétoire
- Fusion/fission membranaire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

Ykt6, R-SNARE, i.e. contenant une arginine (R) dans la couche 0 du motif SNARE, est une t-SNARE (t pour target, cible) impliquée dans le trafic de l'appareil de Golgi et la fusion vésiculaire, en particulier autophagosome/lysosome.
Les R-SNARE comprennent :
- les VAMP (Vesicle-Associated Membrane Protein), formant la majorité des v-SNARE,
- Ykt6 et SEC22B qui font partie de sous-complexes t-SNARE et sont placées comme des Qc-SNARE.
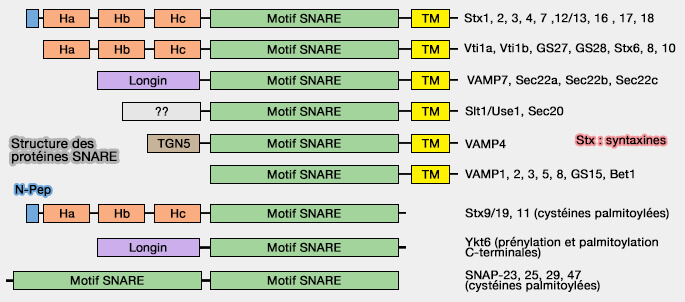
(Figure : vetopsy.fr d'après Hong et Lev)
Structure et activation de Ykt6
1. YKT6 contient un domaine longin à son extrémité N-terminale, similaire à celui de VAMP7, mais ne contient pas de domaine transmembranaire (New insights regarding SNARE proteins in autophagosome-lysosome fusion 2020).

(Figure : vetopsy.fr d'après McGath et coll)
Le ciblage membranaire de YKT6 dépend de son site consensus de prénylation C-terminal (CCAIM), qui est modulé de manière réversible par la palmitoylation (Localization and activity of the SNARE Ykt6 determined by its regulatory domain and palmitoylation 2004).
2. La conformation inactive soluble de Ykt6 est stabilisée par le groupe farnésyl, pris en sandwich entre le domaine SNARE et le domaine longin (Autophagosomal YKT6 is required for fusion with lysosomes independently of syntaxin 2018).
a. La phosphorylation sur un site conservé au cours de l'évolution dans le domaine SNARE peut réguler un changement conformationnel d'une forme cytosolique fermée à une forme plus ouverte liée à la membrane.
- La palmitoylation de Ykt6 entraîne l'insertion de la membrane, la libération du farnésyl et donc l'ouverture de Ykt6, qui est alors capable d'interagir avec ses partenaires t-SNARE (Structure and function of longin SNAREs 2015).
- Cette phosphorylation est régulée par la calcineurine (phosphatase dépendante du Ca++) qui détecte les concentrations calciques et transduit cette information en réponses cellulaires, comme dans l'autophagie ou même la maladie de Parkinson (Selective neuronal vulnerability in Parkinson disease 2017).
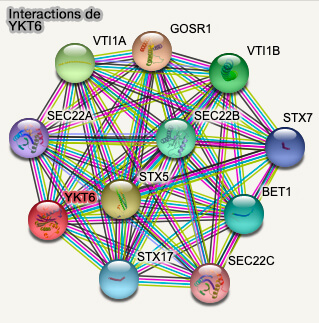
(Figure : vetopsy.fr d'après STRING)
b. La charge négative introduite par la phosphorylation crée un potentiel électrostatique supplémentaire de la protéine qui entraîne la séparation des domaines hydrophobes longin et ykt6fonct.
Rôles de Ykt6
1. Ykt6 est impliquée dans :
- les transports réticulum endoplasmique (RE)/appareil de Golgi, intra-Golgi, endosome/Golgi et dans les étapes de transport vacuolaire,
- les réactions de fusion membranaire qui entraînent l'expansion et la fermeture de la membrane des autophagosomes ainsi que leur fusion avec les lysosomes (SNARE Proteins Are Required for Macroautophagy 2012).
2. YKT6 mammalien intervient dans le processus de fusion autophagosome/lysosome (New insights regarding SNARE proteins in autophagosome-lysosome fusion 2021).
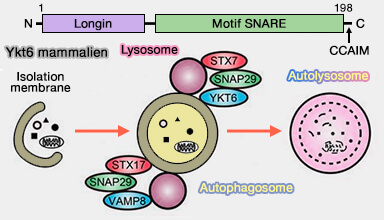
(Figure : vetopsy.fr d'après Baker et coll)
YKT6 se couple à SNAP-29 et STX7 de manière indépendante de STX17 (Autophagosomal YKT6 is required for fusion with lysosomes independently of syntaxin 17 2018).
- YKT6 est recruté dans les autophagosomes via son domaine longin.
- YKT6-SNAP-29-STX7 fonctionne probablement comme un deuxième complexe SNARE fonctionnel en plus du complexe STX17-SNAP-29-VAMP8 chez les mammifères.
Remarque : chez la drosophile, Ykt6, localisé dans les lysosomes, est capable de former un complexe SNARE avec Syx17-Snap-29, jusqu'à la participation de Vamp7, qui remplace Ykt6 dans le complexe SNARE définitif, i.e. il agit plutôt comme un régulateur que comme un élément de machinerie de fusion (Non-canonical role of the SNARE protein Ykt6 in autophagosome-lysosome fusion 2018).
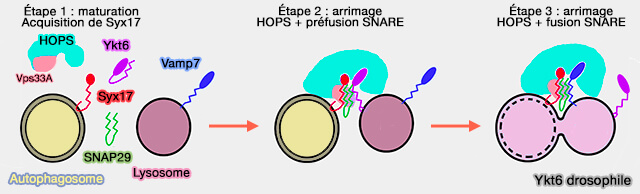
(Figure : vetopsy.fr d'après Takáts et coll)
Sec22
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


