Domaines protéiques
Domaines protéiques à doigt de zinc
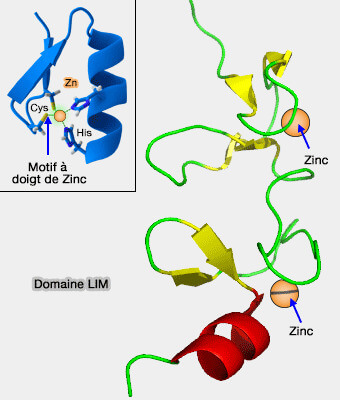
Domaine LIM

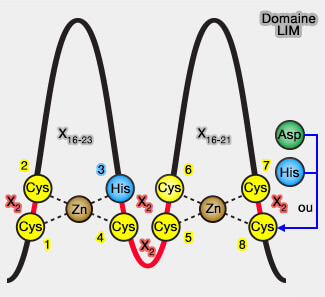
Les domaines LIM sont composés de deux domaines contigus à doigt de zinc, séparés par deux résidus hydrophobes.
Ce domaine protéique eucaryote très ancien a pris naissance avant le dernier ancêtre commun des plantes, des champignons, des amibes et des animaux.
(Figure : vetopsy.fr)
Son nom découle de sa découverte dans les protéines Lin11 de Caenorhabditis elegans , Isl1 du rat et Mec-3 de Caenorhabditis elegans (The LIM domain: regulation by association 2000).
Domaine LIM
1. Le domaine LIM est composé de 50 à 65 résidus.
a. Sa structure comporte :
- deux motifs à doigt de zinc,
Le premier zinc-finger comprend en règle générale le domaine canonique avec une histidine remplacée par une cystéine, et le deuxième zinc-finger, 4 cystéines pour stabiliser les ions Zn++.
- un lien hydrophobe entre les deux de 2 résidus seulement.
(Figure : vetopsy.fr d'après Bssophile
et Thomas Splettstoesser)
b. La structure consensus est : Cys-X2-Cys-X16-23-His-X2-Cys-X2-Cys-X2-Cys-X16-21-Cys-X2-Cys/His/Asp (Asp et His pouvant remplacer Cys).
2. Ce domaine est trouvé, sur le site vetopsy.fr dans :
- les gènes homéobox LIM (Lhx),
- les LIMK (LIM kinases), régulant de nombreuses kinases (en particulier les petites GTPases),
- de nombreuses protéines LIM interagissant avec le cytosquelette (migfiline, paxilline, zyxine…).
Protéines à domaine LIM
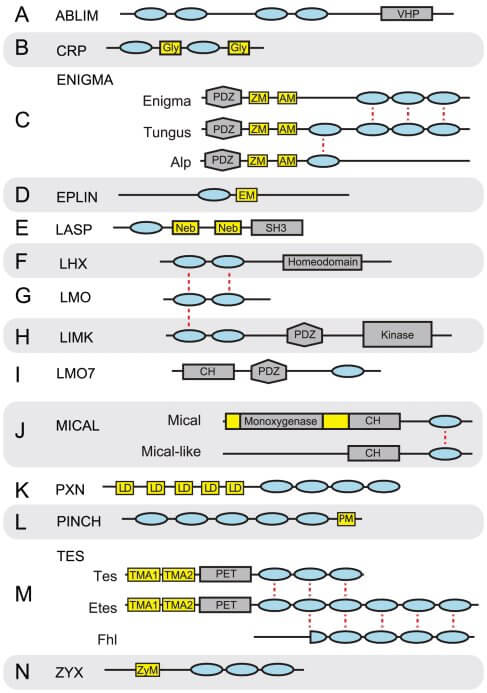
Les protéines LIM sont réparties en 14 classes (The Diversification of the LIM Superclass at the Base of the Metazoa Increased Subcellular Complexity and Promoted Multicellular Specialization 2012 pour une revue).
Sur la figure ci-dessous, le domaine LIM est en bleu, et les autres domaines sont VHP (Villin Headpiece Domain), Gly (Glycine rich region), ZM (Zasp Motif), AM (Alp Motif), EM (EPLIN Motif), Neb (Nebulin repeat), SH3 (SRC Homology 3), HD (HomeoDomain), CH (Calponin Homology), LD (leucine-aspartate repeat), PM (PINCH Motif), TMA1 (TES Motif A1), TMA2 (TES Motif A2), ZyM (ZYX Motif)
1. Les ABLIM codent pour les protéines d'échafaudage (scaffold protein) des adhérences focales et des jonctions adhérentes (interactions actine/cibles cytoplasmiques) et activent des cascades de signalisation du cytosquelette qui conduisent à la transcription.
2. Les CRP stabilisent l'α-actinine et sont des protéines d'échafaudage des adhérences focales. Ce sont aussi des régulateurs de la transcription.
3. Les ENIGMA possèdent des rôles identiques aux précédents.
4. Les EPLIN favorisent le regroupement et la stabilisation des fibres de stress et agissent comme protéines d'échafaudage (scaffold protein) pour associer les processus d'adhésion cellulaire (en particulier, cadhérine/caténine) avec le cytosquelette.
(Figure d'après KOCH sous Open Source)
5. Les LASP stabilisent les filaments d'actine-F et les plaques d'adhésion focale via les répétitions de nébuline.
NRAP est une protéine de muscle strié impliquée dans l'assemblage des myofibrilles et de l'organisation du sarcomère.
6. Les Lhx sont des homéoboîtes qui jouent un rôle dans le développement, en particulier du système nerveux (cf. XLim5 du xénope).
7. Les LMO régulent l'expression de facteurs de transcription, mais ne possèdent pas d'homéoboîte comme les LHX.
8. Les LIMK sont des sérine/thréonine kinases qui phosphorylent les membres de la famille ADF/cofiline, protéine de fragmentation essentielle pour le remodelage très rapide du cytosquelette d'actine.
9. Le LMO7 mammalien est impliqué dans la polymérisation de l'actine et de stabilisation de l'actine-F dans les adhérences focales, en réponse à un stress mécanique. Il est aussi un régulateur transcriptionnel puissant.
10. Les MICAL sont impliqués dans la croissance neuronale et le guidage axonal pendant l'embryogenèse (déstabilisation de l'actine).
Les Mical-like jouent un rôle dans le trafic vésiculaire et le recyclage des composants des jonctions serrées.
11. Les PXN ont un rôle similaire aux ABLIM. Phosphorylés, ils recrutent les complexes de protéines pour les adhérences focales et les Rho-GTPases de signalisation pour réguler l'adhésion, la propagation, la motilité et la survie cellulaire.
12. Les PINCH (appelés aussi LIMS) sont des adaptateurs qui assemblent les adhérences focales (intégrines), en jouant sur de multiples voies de signalisation.
13. Les TES ont un rôle dans la transcription.
14. Les ZX sont des adaptateurs qui facilitent l'assemblage des protéines aux adhérences focales et prennent part à la navette cytoplasme/noyau.
Ces protéines ont donc de nombreuses fonctions (The diverse biofunctions of LIM domain proteins: determined by subcellular localization and protein—protein interaction 2007).
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


