Domaines des protéines
Domaine CH et ABD

Le domaine CH (Calponin homology domain) est un motif structural de liaison à l'actine trouvé dans les protéines du cytosquelette et les protéines de transduction du signal. Le domaine ABD contient deux domaines CH en tandem.
Domaine CH
1. Le domaine CH a été retrouvé tout d'abord dans le domaine N-terminal de la calponine, d'où son nom (Calponin homology domains at a glance 2002).
La calponine, protéine calcium-dépendante modulée par la calmoduline, est un régulateur essentiel de la contraction des muscles lisses en inhibant l'activité ATPase de la myosine.
(Figure : vetopsy.fr d'après Yin et coll)
2. Le domaine CH est principalement α-hélicoïdal et les résidus strictement conservés dans les hélices α constituent un noyau hydrophobe invariant ((The structure of the N-terminal actin-binding domain of human dystrophin and how mutations in this domain may cause Duchenne or Becker muscular dystrophy 1999).
a. Le domaine CH contient six hélices α au total :
- un noyau de quatre hélices α.
- III, IV et VI forment un faisceau,
- I est perpendiculaire à ce faisceau,
- deux structures hélicoïdales courtes (II et V)
- une hélice 310 dans la boucle entre les hélices IV et V.
Remarque : elles sont aussi appelées A à G.
b. Les résidus de tryptophane (W) dans l'hélice I et d'aspartate (D) dans l'hélice VI sont les résidus les plus conservés, tandis que le motif consensuel DGXXLL apparaît dans l'hélice III.
Une charnière, i.e. GLQQTN dans la région de liaison entre le domaine CH1-CH2 de la dystrophine, permet les transitions conformationnelles (Dynamics of Dystrophin’s Actin-Binding Domain 2018).

(Figure : vetopsy.fr d'après Yin et coll)
b. La majorité des domaines CH sont généralement situés à l’extrémité N-terminale des protéines.
Le domaine CH de SMTNL1 (Smoothelin-like 1) se trouve à son extrémité C-terminale, avec un motif KTKKK qui pourrait être le site potentiel d’ubiquitination (Solution Structure of the Calponin Homology (CH) Domain from the Smoothelin-like 1 Protein 2008).
Liaisons du domaine CH
Domaine ABD

et liaisons classiques de l’actine
(Figure : vetopsy.fr d'après Harris et coll)
1. Le domaine ABD (Actin Binding domain) est un domaine formé de deux domaines CH disposés en tandem (CH1 et CH2), qui se retrouvent dans de nombreuses ABP (Actin Binding Protein) telles que la dystrophine, la spectrine, l'α-actinine, la filamine, la fimbrine… (

Les mécanismes exacts régissant la liaison entre l'actine et le domaine CH ne sont toujours pas clairs (Steric regulation of tandem calponin homology domain actin-binding affinity 2019).
2. La liaison du domaine CH1-CH2 et de l'actine est régulée mécaniquement par des conformations fermées ou ouvertes.
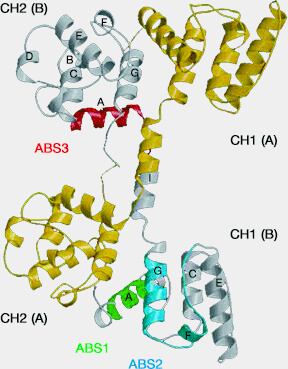
Dans des études anciennes, trois sites putatifs (ABS1, 2 et 3) ont été proposés (High-resolution cryo-EM structure of the F-actin–fimbrin/plastin ABD2 complex 2008) :
- l'hélice N-terminale αA de CH1 (ABS1),
- l'hélice C-terminale αG de CH1 (ABS2), qui serait aussi impliquée dans l'interaction entre l'actine et l'α-actinine.
- le lien interdomaine flanqué du segment N-terminal de CH2 comprenant l'hélice αA (ABS3).
3. Cependant, le tandem de domaine CH est normalement fermé, et il n'y a pas eu de consensus sur les limites de ces sites, et les données cristallographiques n'ont pas pu les concilier avec une surface continue de liaison.
a. ABS1 est en grande partie enterré dans l'interface CH1-CH2 et ne devient accessible que dans la conformation ouverte, et il semble que ni l'ABS1 ni l'ABS3 entraînant directement l'actine F (Structural basis of the filamin A actin-binding domain interaction with F-actin 2019).

(Figure : vetopsy.fr d'après Iwamoto et coll)
Au lieu de cela, l'ABD lie F-actine par l'intermédiaire d'une séquence courte immédiatement N-terminale au domaine CH1, i.e. ABS-N, ainsi que l'ABS2 prédit et les résidus structurellement adjacents qui n'étaient pas précédemment impliqués dans la liaison de la F-actine, i.e. s ABS2'.
b. Le domaine CH2 servirait de domaine de localisation pour positionner les véritables motifs de liaison à actine.
Autres liaisons du domaine CH
Le domaine CH peut se lier aussi (Structural Characteristics, Binding Partners and Related Diseases of the Calponin Homology (CH) Domain 2020) :
- à la tubuline,
- à des kinases comme ERK,
- à la calmoduline…
Maladies liées au domaine CH
Des maladies sont liées au domaine CH de protéines, telles que (Structural Characteristics, Binding Partners and Related Diseases of the Calponin Homology (CH) Domain 2020) :
- MICAL1/2 pour les maladies neurales et les cancers, lié à la tubulation, en particulier des endosomes de recyclage (Modulation of MICAL Monooxygenase Activity by its Calponin Homology Domain: Structural and Mechanistic Insights 2016).
- Smoothelin-like 1…
Retour aux domaines protéiques
Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesDomaines protéiquesModifications post-traductionnelles des protéinesDégradations des protéinesUbiquitinationGlucidesLipidesEnzymesCoenzymesVitaminesHormonesTransport membranaireMoteurs moléculairesVoies de signalisation


