Trafic vésiculaire
Endophiline
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les endophilines sont une famille de protéines conservée évolutivement, impliquées dans la dynamique membranaire et l'endocytose.
Vue d'ensemble des endophilines
1. L'endophiline régule différentes fonctions biologiques comme (Biology of endophilin and it’s role in disease 2023) :
- l'endocytose, aussi bien clathrine-dépendante (CME) que clathrine-indépendante (CIE), en particulier la FEME (FAST Endophilin-mediated Endocytosis),
- les changements morphologiques mitochondriaux,
- l'apoptose,
- la formation d'autophagosomes.
2. Les endophilines sont impliquées dans le développement et la progression de maladies comme (
- les maladies neurodégénératives, dans lesquelles, en général, l'expression de l'endophiline A1 est augmentée,
- les tumeurs, dans lesquelles, en général, l'expression de l'endophiline A1 est diminuée, contrairement à celle de l'endophiline A, en particulier dans les cancers colo-rectaux (Competition between TIAM1 and membranes balances Endophilin A3 activity in cancer metastasis 2019).
- les maladies cardiovasculaires,
- les maladies auto-immunes.
Structure des endophilines
Les endophilines sont des protéines composées de deux domaines fonctionnels :
- un domaine N-BAR N-terminal,
- un domaine SH3 C-terminal, connecté au domaine BAR par une région d'épissage de longueur variable (Unfolding Mechanisms and Conformational Stability of the Dimeric Endophilin N-BAR Domain 2021).

(Figure : vetopsy.fr d'après Takahashi et coll)
1. Le domaine structurel SH3 interagit avec des motifs riches en proline (PRM ou PRD) comme ceux des protéines synaptiques et la dynamine (Amphipathic Motifs Regulate N-BAR Protein Endophilin B1 Auto-inhibition and Drive Membrane Remodeling 2021).
2. Le domaine N-BAR possède trois régions fonctionnelles majeures (A time course of orchestrated endophilin action in sensing, bending, and stabilizing curved membranes 2016) :
- l'hélice amphiphile N-terminale (H0), qui assure la liaison à la membrane,
- l'hélice amphiphile insérée dans l'hélice 1 (H1 ou H1I, I pour Insertion), qui s'insère dans la membrane,
- le domaine structurel, en forme de croissant formé par sa dimérisation, qui coopère avec H1 pour courber la membrane.

La scission (vésicules) versus échafaudage (tubules) est étudiée dans un chapitre spécial.
a. Le domaine N-BAR favorise la détection, la stabilisation et la formation de la courbure de la membrane au-delà de celle d'un domaine BAR ordinaire.
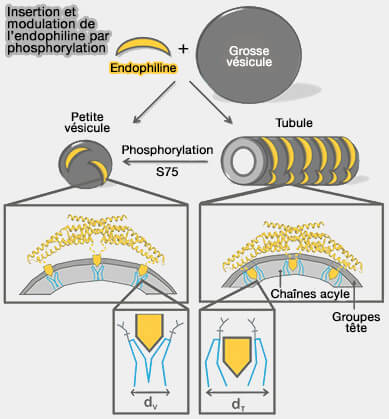
par phosphorylation
(Figure : vetopsy.fr d'après Ambroso et coll)
b. Ce domaine est nécessaire pour :
- la liaison à la bicouche lipidique et induire la flexion de la membrane,
- l'induction et la stabilisation de la courbure de la membrane lors de la dimérisation (Curvature dependence of BAR protein membrane association and dissociation kinetics 2022).
Membres de la famille
Les endophilines sont une famille de protéines conservée évolutivement qui est impliquée dans la dynamique des membranes (Biology of endophilin and it’s role in disease 2023).
Cette famille se compose de deux sous-familles et de cinq isoformes distribuées dans divers tissus.
Famille de l'endophiline A
La famille de l'endophiline A, qui régule l'endocytose à travers son domaine SH3 C-terminal et son domaine BAR N-terminal, est principalement localisée dans le cytoplasme et comprend trois isoformes :
- l'endophiline A1, principalement exprimée dans les tissus cérébraux (Distinct Functions of Endophilin Isoforms in Synaptic Vesicle Endocytosis 2015),
- l'endophiline A2, distribuée dans différents tissus et organes, tels que le pancréas, le placenta, la prostate, les testicules et l'utérus (Dimeric Endophilin A2 Stimulates Assembly and GTPase Activity of Dynamin 2 2011),
- l'endophiline A3, exprimée dans le cerveau et les tissus testiculaires.
Famille de l'endophiline B
La famille de l'endophiline B se compose de deux isoformes.
1. L'endophiline B1, fortement exprimée dans le cœur, les muscles squelettiques, le rein et le placenta, est principalement localisée dans les membranes intracellulaires, mitochondriales, de l'appareil de Golgi et autophagosomales (Association of Endophilin B1 with Cytoplasmic Vesicles 2016 et Amphipathic Motifs Regulate N-BAR Protein Endophilin B1 Auto-inhibition and Drive Membrane Remodeling 2020).
a. L'endophiline B1, appelée aussi facteur d'interaction Bax ou BIF-1, interagit avec Bax pour favoriser la libération du cytochrome C dans les mitochondries (Bax Activates Endophilin B1 Oligomerization and Lipid Membrane Vesiculation 2009).
L'endophiline B1 active également la voie de signalisation liée à l'apoptose pour favoriser l'apoptose cellulaire.
b. L'endophiline B1 induit l'autophagie en formant un complexe avec Beclin-1, puis active la signalisation de la PI3KC3-CI (Bif-1/Endophilin B1: a candidate for crescent driving force in autophagy 2010).
Elle joue aussi un rôle dans le trafic d'ATG9.
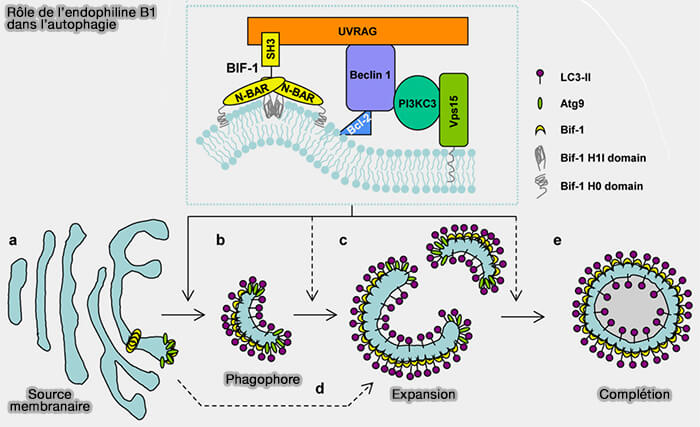
(Figure : vetopsy.fr d'après Takahashi et coll)
2. L'endophiline B2, dans le muscle squelettique, le tissu adipeux, le poumon, le cerveau et la glande mammaire (A tumor-specific neoepitope expressed in homologous/self or heterologous/viral antigens induced comparable effector CD8+ T-cell responses by DNA vaccination).
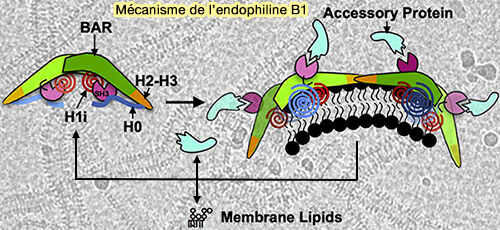
(Figure : vetopsy.fr d'après Bhatt et coll)
Rôles de l'endophiline A dans l'endocytose
L'endophiline A est impliquée dans l'endocytose :
- clathrine-dépendante (CME),
- clathrine-indépendante (CIE), en particulier la FEME (FAST Endophilin-mediated Endocytosis).

La FEME (FAST Endophilin-mediated Endocytosis) est étudiée dans un chapitre spécial.

(Figure : vetopsy.fr d'après Sacramento et Boucrot)
1. L'endophiline A est impliquée dans la voie d'endocytose médiée par la clathrine (CME) et régule la formation de vésicules synaptiques, i.e. la croissance, la division et le déshabillage (Distinct Functions of Endophilin Isoforms in Synaptic Vesicle Endocytosis 2015 et BRAG2a Mediates mGluR-Dependent AMPA Receptor Internalization at Excitatory Postsynapses through the Interaction with PSD-95 and Endophilin 3 2020).
- Les endophilines A (1, 2 et 3) permettent de recruter la dynamine pour la scission et la synaptojanine pour le déshabillage de clathrine après fission (Recruitment of endophilin to clathrin coated pit necks is required for efficient vesicle uncoating after fission 2011).
- Les endophilines ont été détectées au niveau des puits à clathrine en microscopie électronique et de fluorescence.
- Des mutations des endophilines bloquent la formation par CME des vésicules des neurotransmetteurs.

(Figure : vetopsy.fr d'après Milosevic)
2. Toutefois, il est essentiel de remarquer que :
- seulement un quart des puits à clathrine sont positifs aux endophilines (A High Precision Survey of the Molecular Dynamics of Mammalian Clathrin-Mediated Endocytosis 2011),
- son rôle est redondant dans le CME et peut être largement soutenu par l'amphiphysine et la nexine SNX9 (Cooperative Recruitment of Dynamin and BIN/Amphiphysin/Rvs (BAR) Domain-containing Proteins Leads to GTP-dependent Membrane Scission 2011).
Remarque : par contre, le rôle de l'endophiline est essentiel dans la FEME (Quantitative and Statistical Study of the Dynamics of Clathrin-Dependent and -Independent Endocytosis Reveal a Differential Role of Endophilin A2 2018).
3. L'endophiline A est impliquée dans la rupture de la membrane et la libération des vésicules, i.e. le domaine SH3 se lie aux motifs riches en proline (PRM ou PRD) d'autres protéines endocytées, comme les protéines synaptiques et la dynamine.
- Le domaine SH3 s'assemble autour du cou des fosses encapsulées par la clathrine avec des initiateurs (ALG-2 interacting protein-X (Alix) is essential for clathrin-independent endocytosis and signaling 2018).
- Le domaine N-BAR de l'endophiline A possède une activité d'acide lysophosphatidique acyltransférase (LPAAT) qui pourrait courber la membrane lipidique lors de la formation des vésicules.

(Figure : vetopsy.fr d'après Daumke et coll)
Endocytose clathrine-dépendante
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


