Phosphatases
Phosphatases SAC
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les phosphatases SAC, qui ne font pas parties intrinséquement des phosphatidylinositol phosphatases (PI phosphatases), sont des phosphatases qui peuvent aussi retirer le groupe phosphate de différents hydroxyles du noyau de l'inositol des phosphoinositides.
Les phosphatases SAC appartiennent à un groupe d'inositol-phosphate phosphatases non spécifiques (EC 3.1.3.25) contenant un domaine Sac, qui hydrolyse le phosphate en position 3, 4 ou 5.
$\ce{PIP + H2O}$ $\leftrightharpoons$ $\ce{PI + phosphate}$
Le domaine catalytique des phosphatases de la famille Sac conserve le motif CX5R, que l'on trouve couramment dans les PI phosphatases.

Vous pouvez lire : The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis (2015) et Phosphatidylinositol Kinases and Phosphatases in Entamoeba histolytica (2019).
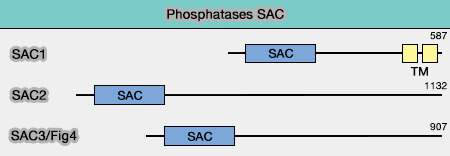
(Figure : vetopsy.fr d'après Nakada et coll)
La famille SAC compte trois membres :
- Sac1,
- Sac2/INPP5F,
- Sac3/Fig4.
Structure
de SAC1
1. Le centre catalytique Sac1 est différent des motifs CX5R classiques, ici CMDCLDR(/T/S), comme celui de PTEN ou des myotubularines (Crystal structure of the yeast Sac1: implications for its phosphoinositide phosphatase function 2010).
D'une part, le domaine catalytique de Sac1 est unique par son feuillet β central large et divisé par rapport aux autres tyrosine phosphatases (
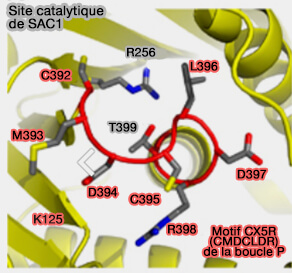
(Figure : vetopsy.fr d'après Manford et coll)
D'autre part, dans SAC1, la cystéine catalytique (C392) est orientée loin de l'arginine conservée (R398), tandis que le résidu correspondant dans PTEN ou les myotubularines fait face à l'arginine et génère un centre actif étroit (
- Le centre catalytique de Sac1 subit probablement un changement de conformation au cours de la catalyse.
- Sac1 est une enzyme allostérique et son activité est stimulée par les phospholipides anioniques (Allosteric Activation of the Phosphoinositide Phosphatase Sac1 by Anionic Phospholipids 2012).
2. Le domaine SAC, considéré comme une PI phosphatase avec une large spécificité, est très proche de celui des synaptojanines, PI 5-phosphatases de type II.
Ce domaine permet l'élimination du groupe phosphate de l'hydroxyle 3, 4 et/ou 5 du noyau de l'inositol de divers phosphoinositides.
- Sac1 déphosphoryle PI(3)P, PI(4)P et PI(3,5)P2, mais pas PI(4,5)P2 ou PIP2.
- Sac2 déphosphoryle la position D5 de PI(4,5)P2 ou PIP2 et PI(3,4,5)P3 ou PIP3.
- Sac3/Fig4 n'hydrolyse que le PI(3,5)P2.
Localisation et rôles de SAC
Localisation et rôles de SAC1
1. Sac1 est principalement localisé sur le réticulum endoplasmique (RE) et fait la navette entre l'appareil de Golgi et le RE. Sac1 hydrolyse principalement PI(4)P.
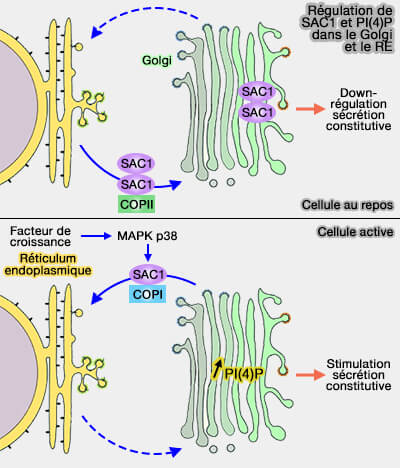
(Figure : vetopsy.fr d'après Blagoveshchenskaya et coll)
L'extrémité C-terminale de Sac1 interagit avec le complexe COPI via un motif KxKxx conservé et cette association induit la récupération de Sac1 au RE (Integration of Golgi trafficking and growth factor signaling by the lipid phosphatase SAC1 2008).
- Dans les cellules au repos, SAC1 s'oligomérise et s'accumule dans le Golgi, qui, à son tour, entraîne une down-régulation de PI(4)P et de la sécrétion constitutive.
- Après la stimulation des facteurs de croissance, l'activité MAPK P38 est sollicitée pour dissocier les complexes SAC1, ce qui enclenche le trafic rétrograde et la redistribution de SAC1 dans le réticulum endoplasmique. La réduction du SAC1 au niveau du Golgi augmentent la concentration de PI(4)P et accélère la sécrétion constitutive.
2. Sac1 est impliqué dans le maintien des niveaux de PI(4)P dans la membrane plasmique (MP) aux jonctions RE-membrane plasmique (Osh Proteins Regulate Phosphoinositide Metabolism at ER-Plasma Membrane Contact Sites 2011).
Le métabolisme PI(4)P médié par Sac1 nécessite les protéines Osh - OxySterol-binding Homology - (Structure of Osh3 Reveals a Conserved Mode of Phosphoinositide Binding in Oxysterol-Binding Proteins 2013).
- Osh3, par son domaine PH, Osh3 se localise sur les sites de contact membranaire RE/MP en fonction des niveaux de PI(4)P membranaire et activerait Sac1.
- Les protéines VAP (Vesicle-associated membrane protein-Associated Protein) membranaires du réticulum endoplasmique (RE), Scs2/Scs22 de la levure, contrôlent la synthèse du phosphatidylinositol, et par là-même, les niveaux PI(4)P plasmatique et l'activité Sac1 (Desumoylation of the Endoplasmic Reticulum Membrane VAP Family Protein Scs2 by Ulp1 and SUMO Regulation of the Inositol Synthesis Pathway 2012 et Vesicle-associated Membrane Protein-associated Protein-A (VAP-A) Interacts with the Oxysterol-binding Protein to Modify Export from the Endoplasmic Reticulum 2002).
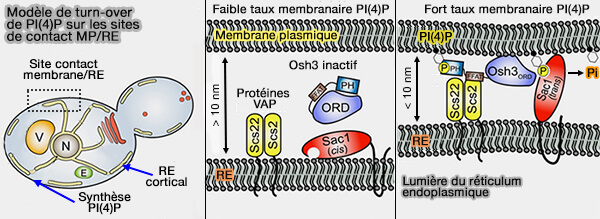
(Figure : vetopsy.fr d'après Stefan et coll)
Localisation et rôles de SAC2
1. SAC2 est un régulateur négatif spécifique aux mammifères de la voie PI3K/Akt (Hdac2 regulates the cardiac hypertrophic response by modulating Gsk3b activity 2007).

La voie AKT (ou PI3K/AKT) est étudiée dans un chapitre spécifique.
2. Sac2 est impliqué dans la voie endocytaire en tant que PI 4-phosphatase (Sac2/INPP5F is an inositol 4-phosphatase that functions in the endocytic pathway 2015).
-
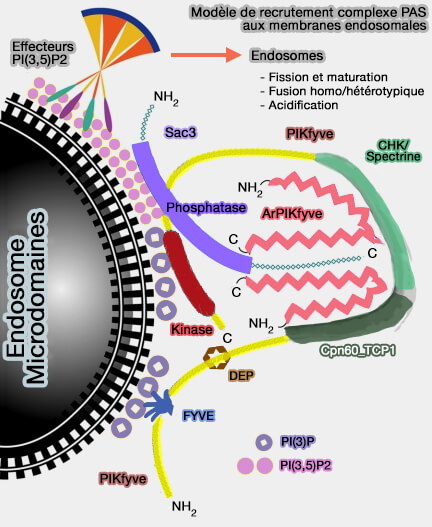
Modèle de recrutement du complexe PAS
(Figure : vetopsy.fr d'après Ikomonov et coll) - SAC2 et OCRL pourraient coopérer dans la déphosphorylation de PI(4,5)P2 ou PIP2 à la position 4 et 5 de l'inositol dans un partenariat semblable aux deux phosphatases des synaptojanines.
Localisation
et rôles de
SAC3/Fig4
1. Sac3/Fig4 régule la voie endocytaire par la régulation des niveaux de PI(3,5)P2.
Une carence en Sac3 provoque une augmentation des niveaux de PtdIns(3,5)P2 et altère la transition tardive des endosomes vers les lysosomes.
2. Sac3/Fig4 également impliqué dans la régulation de l'activité enzymatique du complexe PAS qu'il forme avec PIKfyve et ArPIKfyve/Vac14.

Le complexe PAS, avec ses composants, est étudié dans un chapitre spécifique.
Retour aux phosphatidylinositol phosphatases
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesHydrolasesPeptidases/protéasesPhosphatasesProtéine phosphatasesPI phosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires



