Trafic vésiculaire
Endocytose clathrine-dépendante (CME)
7. Déshabillage de la vésicule
Auxiline/GAK (co-chaperon de Hsc70)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Transports membranaires sans mouvements membranaires
- Transports membranaires avec mouvements membranaires
: trafic vésiculaire
- Fusion/fission membranaire
- Endocytose
- Vue d'ensemble
- Endocytose clathrine-dépendante (CME ou Clathrin-Mediated Endocytosis)
- Reconnaissance de la cargaison
- Adaptateurs à la clathrine
- Formation de la cage de clathrine
- Recrutement des NPF, du complexe Arp2/3 et polymérisation de l'actine
- Détachement de la membrane : fission
- Migration de la vésicule vers l'intérieur de la cellule
- Démontage ou déshabillage de la vésicule de clathrine
- CIE (Clathrin-independant Endocytosis)
- Cycle des vésicules synaptiques
- Exocytose
- Voie sécrétoire
- Protéines membranaires
- Moteurs moléculaires
- Voies de signalisation

L'auxiline/GAK (cyclin G-Associated kinase) fait partie des co-chaperons de Hsc70 impliquée dans le déshabillage des cages de clathrine.
Dans vetopsy.fr, pour plus de clarté, nous avons divisé l'endocytose clathrine-dépendante (CME : clathrin-dependant endocytosis) en 8 étapes.
7. Le déshabillage de la vésicule (uncoating) via des facteurs cytosoliques est une étape indispensable au trafic des vésicules, car le manteau gène l’interaction avec les endosomes précoces.
Ce déshabillage nécessite :
- Hsc70/HSPA8 (70 kDa), protéine appartenant à la famille des protéines de choc thermique et des protéines chaperons ;
- l'auxiline/GAK, qui représente un membre des co-chaperons de Hsc70 (A sequential mechanism for clathrin cage disassembly by 70-kDa heat-shock cognate protein (Hsc70) and auxilin 2011).
Auxiline et co-chaperons de Hsc70
1. L'auxiline/GAK (cyclin G-Associated kinase) fait partie de la famille des NAK (numb-associated kinase).
Chez l'homme, cette famille, dont les membres présentent une grande diversité de séquences et de structures par rapport aux autres kinases ainsi qu'au sein de leur famille comprend aussi (Family-wide Structural Analysis of Human Numb-Associated Protein Kinases 2016) :
- STK16 (Serine/Threonine Kinase 16)/MPSK1 (Myristoylated and Palmitoylated Serine/Threonine Kinase 1), protéine associée à la membrane qui est principalement localisée au Golgi et participe à la voie de signalisation TGF-β, à la sécrétion et au tri des protéines du réseau trans-Golgi (TGN), au cycle cellulaire et à la régulation de l'assemblage du Golgi (Serine/Threonine Protein Kinase STK16 2019),
- AAK1 (Adaptor-Associated Kinase 1), impliquée dans la phosphorylation de la sous-unité μ2 de AP-2,
- BIKE/BMP2K [BMP2 (bone morphogenetic protein 2)-inductible kinase].

(Figure : vetopsy.fr d'après Xing)
2. L'auxiline fait partie des co-chaperons de Hsc70 (A burst of auxilin recruitment determines the onset of clathrin-coated vesicle uncoating 2006 et Recruitment dynamics of GAK and auxilin to clathrin-coated pits during endocytosis 2006 et Structure of clathrin coat with bound Hsc70 and auxilin: mechanism of Hsc70‐facilitated disassembly 2009).
3. GAK est un partenaire de la cycline G et de CDK5 et parmi ses fonctions connues, certaines sont partagées avec AAK1.
Elle est essentielle :
- au trafic de clathrine en assurant la liaison à la membrane plasmique et auréseau trans-Golgi (TGN),
- au maintien de la maturation du centrosome et de la progression de la mitose.
4. Les GAK agissent comme l'AAK1, sérine/thréonine kinase qui phosphoryle la sous-unité μ des adaptateurs classiques pour multiplier par 100 leur affinité pour le cargo et la membrane.
Elles sont impliquées dans le trafic des récepteurs comme le récepteur du facteur de croissance épidermique (Multiple Roles for Cyclin G-Associated Kinase in Clathrin-Mediated Sorting Events 2005).
5. Lors du recrutement de la dynamine pour détacher la vésicule de la membrane, on constate un pic de recrutement de l'auxiline et une augmentation du PI(3,4)P2 (A burst of auxilin recruitment determines the onset of clathrin-coated vesicle uncoating 2006).

Le recrutement de l'auxiline suit les variations temporelles de la composition en phosphoinositides, dicté par les spécificités différentielles de leurs domaines de type PTEN.
Structure de l'auxiline
Deux isoformes d'auxiline étroitement apparentées sont trouvées chez l'homme.
1. GAK (cyclin G–Associated Kinase, encore appelée auxiline 2), exprimée dans toutes les cellules, possède :
- un domaine sérine/thréonine kinase,
- un domaine PTEN-like pour la liaison aux lipides,
- un domaine de liaison à la dynamine et à la clathrine,
- un domaine J C-terminal.
2. L'auxiline 1, exprimée principalement dans les neurones ne possède pas de domaine kinase N-terminal.
L'auxiline comprend plusieurs domaines (Structure of cyclin G-associated kinase (GAK) trapped in different conformations using nanobodies 2014).
Domaines de liaisons aux protéines
Domaine J
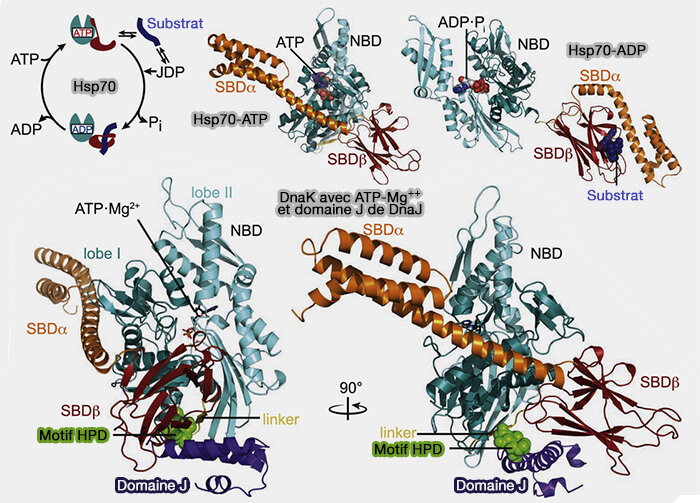
1. Le domaine J de l'auxiline recrute Hsc70 et active son activité ATPasique pour qu'il puisse ouvrir son " couvercle " (NMR Structure of the J-domain and the Gly/Phe-rich Region of theEscherichia coliDnaJ Chaperone 1996 et The J-protein family: modulating protein assembly, disassembly and translocation 2004).
- Le domaine J est retrouvé à l'extrémité N-terminale des JDP (J-Domain Protein) de classe A et B, et n'importe où dans la classe C (The Hsp70 chaperone machinery: J-proteins as drivers of functional specificity 2010)
- Les JDP de classe A et de classe B sont considérés comme des co-chaperons généraux qui interagissent avec des protéines dépliées, mal repliées ou agrégées et les transfèrent à Hsp70.

Pour tout savoir sur le domaine J, lire : Molecular Mechanism of J-Domain-Triggered ATP Hydrolysis by Hsp70 Chaperones (2018).
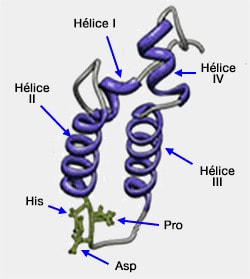
2. Le domaine J est une structure en épingle à cheveu de 70 à 75 acides aminés.
- Ce domaine contient un motif HPD (H35, P36, D37) situé dans une boucle entre les deux hélices principales (II et III), essentiel pour stimuler l'activité ATPase de Hsc70.
-
Cette hydrolyse permet le changement conformationnel des Hsc70 en déplaçant le SBD du NBD et permettre ainsi sa liaison au substrat, ici le motif QLMLT des domaines C-terminaux des chaînes lourdes (
mécanisme général de Hsc70).
(Figure : vetopsy.fr d'après Kityk et coll)
Autres domaines de liaison
1. L'auxiline possède un domaine de liaison à la clathrine et à l'AP2 (résidus 547-910).
- Ce domaine contient plusieurs sites de liaison caractérisés par une gamme de motifs (DLL, MTP, WDW et NWQ).
- Les motifs principaux, entre les résidus 547 à 714, sont censés se lier principalement à la cuisse, partie proximale (CHCR6 et 7).
- Les motifs entre les résidus 716 à 910 sont censés se lier principalement à la jambe (Multiple Interactions of Auxilin 1 with Clathrin and the AP-2 Adaptor Complex 2001 et Structure of clathrin coat with bound Hsc70 and auxilin: mechanism of Hsc70-facilitated disassembly 2009).
2. Le domaine de liaison à la dynamine précède le domaine précédent.
Domaines de liaisons aux lipides
(Figure : vetopsy.fr d'après Guan et coll)
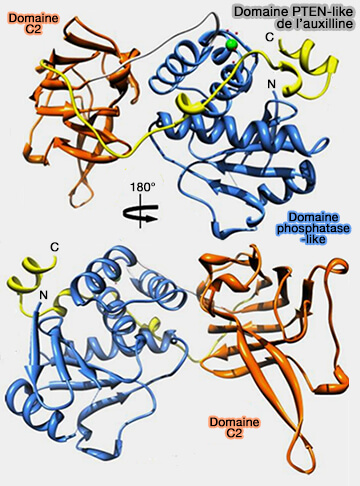
1. Le domaine de liaison aux lipides est composé d'un domaine PTEN-like (Phosphatase and TENsin homolog) qui contient :
- le domaine phosphatase-like (PD : résidus 54–216),
- le domaine C2 de type 2 (résidus 226–363).
Normalement, le domaine de la phosphatase PTEN déphosphoryle les PI(3,4,5)P3 ou PIP3 de la membrane (au niveau du 3-phosphate du cycle inositol : ce sont des 3-phosphatases) pour produire du PI(4,5)P2 ou PIP2.
Le domaine PTEN-like a seulement 27% d'homologie avec le PTEN classique (Interactions of the Auxilin-1 PTEN-like Domain with Model Membranes Result in Nanoclustering of Phosphatidyl Inositol Phosphates 2013).
2. Le domaine PD n'a pas d'activité catalytique.
Toutefois, il se lie à la membrane de manière non spécifique par ses résidus chargés positivement 53-60 et 88-99 .
3. Le domaine C2 de type 2 de l'auxiline a la particularité de ne pas comporter, comme de nombreux autres, les résidus impliqués la liaison membranaire Ca++ dépendante (
Le domaine C2 est essentiel pour le recrutement et l'association de l'auxiline avec les vésicules de clathrine(Structure of the PTEN-like Region of Auxilin, a Detector of Clathrin-Coated Vesicle Budding 2010).
- Son absence ne permet pas la liaison.
- Il semble être le détecteur qui signale le détachement de la vésicule de la membrane plasmique.

(Figure : vetopsy.fr d'après Guan et coll)
Le domaine C2 comporte une boucle 3 plus longue que celle du PTEN classique.
- Cette boucle en forme d'épingle β torsadée est impliquée dans l'interaction avec la bicouche lipidique par ses résidus chargés positivement 240–245 et 301–316.
- Les lipides chargés négativement, en particulier PI(4,5)P2 ou PIP2 se lient à eux.

L'auxiline est placée alors dans une position favorable pour pouvoir interagir avec la membrane plasmique, la clathrine et l'Hsc70.
- L'extrémité C-terminale du domaine PTEN est positionné de telle sorte que la chaîne polypeptidique qui suit pourrait faire saillie de la membrane vers le manteau de clathrine.
- Les 150 résidus d'acides aminés entre l'extrémité du domaine PTEN-like et la région de liaison à la clathrine pourraient facilement enjamber l'espace entre l'emplacement du domaine J de l'auxiline dans le manteau de clathrine et la membrane de la vésicule.
Retour aux déshabillage des cages de clathrine
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseEndocytose clathrine-dépendante (CME)Endocytoses clathrine-indépendantes (CIE)CavéolesFEMEVoie CLIC/GEECVoie flotillineVoie Arf6IL2RGFR-NCEADBEUFEPinocytoseMacropinocytosePhagocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation


