Enzymes
Groupe des hydrolases (EC 3)
Phosphatases : lipide phosphatases
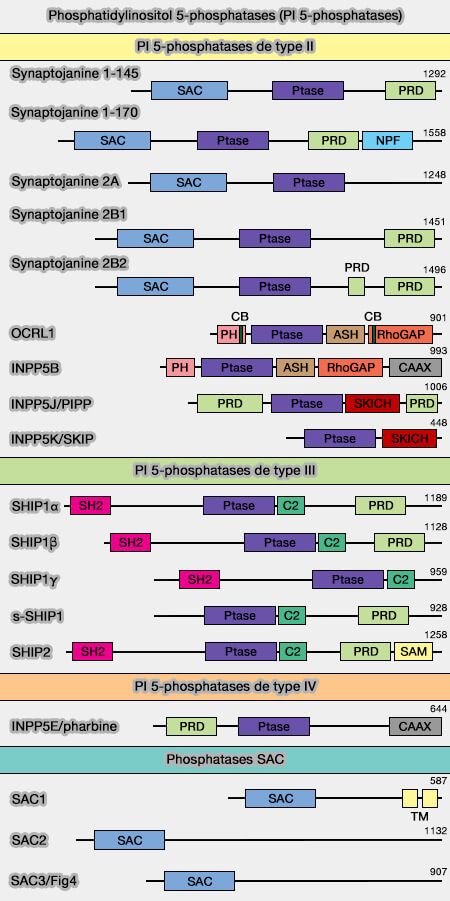
Phosphoinositide 5-phosphatases (PI 5-phosphatases)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les PI 5-phosphatases, appelées aussi inositol polyphosphate 5-phosphatases (INPP5), sont des phosphatidylinositol phosphatases (PI phosphatases) qui retirent le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol des phosphoinositides.
Le focus précoce sur les PI-phosphatases provient de la découverte du second messager IP3 (Inositol(1,4,5)P3) dans les années 1980.

Vous pouvez lire : The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis (2015) et Phosphatidylinositol Kinases and Phosphatases in Entamoeba histolytica (2019).
Vue d'ensemble des PI 5-phosphatases
1. Les inositol polyphosphate 5-phosphatases ou INPP5 (EC 3.1.3.56) sont des enzymes dépendantes de Mg++ qui ont un domaine catalytique caractéristique, homologue de séquence de la famille apurinique/apyrimidique des endonucléases (The Inositol Polyphosphate 5-Phosphatases and the Apurinic/Apyrimidinic Base Excision Repair Endonucleases Share a Common Mechanism for Catalysis 2000).
(Figure : vetopsy.fr d'après Nakada-Tsukui et coll)
2.Le domaine inositol 5-phosphatase (5-Ptase) contient deux motifs de signature séparés par 60-75 résidus, excepté INPP5A séparé de 103 (The Role of Phosphatases in Inositol Signaling Reactions 1999) :
- (F/Y)WXGDXN(F/Y)R,
- P(A/S)(W/Y)( C/T)DR(I/V)L(W/Y).
Classification des INPP5
Les inositol polyphosphate 5-phosphatases (INPP5) regroupe cinq classes (I à V).
PI 5-phosphatases de type I
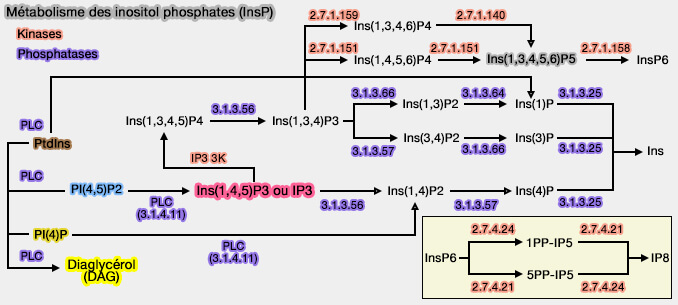
La PI 5-phosphatase de type I, INPP5A, (EC 3.1.3.56).n'a pas d'activité phosphatase lipidique, mais déphosphoryle Ins(1,4,5)P3 et Ins(1,3,4,5)P4.
$\ce{Ins(1,4,5)P3 + H2O}$ $\leftrightharpoons$ $\ce{Ins(1,4)P2 + Phosphate}$
INPP5A produit Ins(1,4)P2 à partir de Ins(1,4,5)P3 ou IP3 et met fin à la signalisation calcique, i.e. IP3 la stimulant la mobilisation du calcium cellulaire alors que Ins(1,4)P2 ne le fait pas.
(Figure : vetopsy.fr)
Autres PI 5-phosphatases
Les membres des autres classes des PI 5-phosphatases (EC 3.1.3.36) hydrolysent le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol des phosphoinositides, i.e. PI(3,4,5)P3 ou PIP3, PI(4,5)P2 ou PIP2, PI(3,5)P2 (Regulation of Phosphoinositide Signaling by the Inositol Polyphosphate5-Phosphatases 2006).
$\ce{P(4,5)P2 + H2O}$ $\leftrightharpoons$ $\ce{PI(4)P + Phosphate}$
1. Les PI 5-phosphatases de type II comprennent :
- les synaptojanines,
- OCRL1 (Oculo-Cerebro-Renal syndrome of Lowe),
- INPP5B,
- INPP5J/PIPP,
- INPP5K/SKIP.
2. Les PI 5-phosphatases de type III comprennent deux SHIP, i.e. SHIP1 et 2.
3. La PI 5-phosphatases de type IV est INPP5E.
Remarque : Les phosphatases Sac (EC 3.1.3.25), qui hydrolyse le phosphate en position 3, 4 ou 5, peuvent aussi agir comme PI 5-phosphatases bien qu'elles ne comportent pas le domaine 5-Ptase.
- Elles contiennent, comme PTEN et les PI 3-phophatases le domaine phosphatase contenant le motif CX5R, ici CKAGRSR.
- Elles diffèrent des PI 5-phosphatases par leur configuration de centre actif et leur de substrat peu spécifique.
Domaine catalytique des PI 5-phosphatases
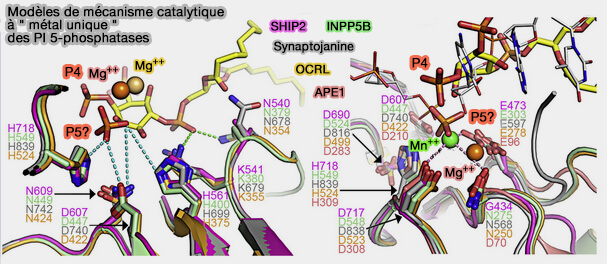
Le domaine catalytique central caractéristique des PI 5-phosphatases présente une grande similitude avec les membres de la famille apurinique/apyrimidique (AP) des AP endonucléases, dont l'AP1 (ou APE1) est bien étudiée, même s'il n'y a pas d'homologie séquentielle (The Inositol Polyphosphate 5-Phosphatases and the Apurinic/Apyrimidinic Base Excision Repair Endonucleases Share a Common Mechanism for Catalysis 2000).
1. Le domaine 5-phosphatase est constitué de deux feuillets β, un contenant à 5 brins, l'autre à 6 brins (Specificity Determinants in Phosphoinositide Dephosphorylation: Crystal Structure of an Archetypal Inositol Polyphosphate 5-Phosphatase 2001).
- Ces deux feuillets s'empilent de manière parallèle pour former un noyau stable en enfouissant entre eux un grand nombre de résidus hydrophobes.
- Les hélices α forment deux couches d'hélices de chaque côté du noyau central du feuillet β.
(Figure : vetopsy.fr d'après Trésaugues et coll)
2. Le site catalytique créé par des boucles et plusieurs hélices se trouve au bord supérieur des deux feuillets β (Structural Basis for Phosphoinositide Substrate Recognition, Catalysis, and Membrane Interactions in Human Inositol Polyphosphate 5-Phosphatases 2014).
Le 5-P se lie dans une poche contenant six résidus hautement conservés dans les 5-phosphatases (Asn379, Lys380, His400, Asp447, Asn449 et His549 dans INPP5B, i.e. en vert sur la figure. Dans cette position, le 5-P interagit directement avec Mg++ et établit également des contacts directs avec His400, His549, Asn449 et Asp 447.
Le mécanisme détaillé de la réaction d'hydrolyse médiée par les endonucléases AP est encore débattu et différents modèles ont été proposés. Ces modèles incluent des mécanismes impliquant soit un ou deux ions Mg++, soit un ion Mg++ en mouvement.
-
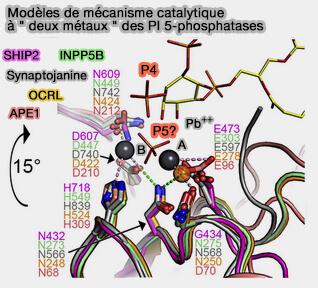
Mécanisme catalytique à " deux métaux "
des PI 5-phosphatases
(Figure : vetopsy.fr d'après Trésaugues et coll - Dans le mécanisme à " deux métaux ", l'hydroxyde effectuant l'attaque nucléophile est coordonné par un métal (B sur la figure ci-contre) qui pourrait également stabiliser l'état de transition. Le deuxième métal (A sur la figure ci-contre) stabiliserait également l'état de transition ou le groupe de départ O3 (Two Divalent Metal Ions in the Active Site of a New Crystal Form of Human Apurinic/Apyrimidinic Endonuclease, Ape1: Implications for the Catalytic Mechanism 2001).
- Une version alternative de ce modèle montrerait qu'un seul métal se déplacerait du site B au site A au cours du cycle catalytique et aiderait à générer l'hydroxyle dans la première partie de la réaction tout en retenant le produit dans la seconde partie (A ‘‘Moving Metal Mechanism’’ for Substrate Cleavage by the DNA Repair Endonuclease APE-1 2007).
PI 5-phosphatases de type II : synaptojanines
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesHydrolasesPeptidases/protéasesPhosphatasesProtéine phosphatasesPI phosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


