Enzymes
Groupe des hydrolases (EC 3)
Phosphatases : lipide phosphatases
Phosphoinositide 5-phosphatases de type II
INPP5J/PIPP et INPP5K/SKIP
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les PI 5-phosphatases, encore appelées inositol polyphosphate 5-phosphatases (INPP5) sont des phosphatidylinositol phosphatases (PI phosphatases) qui retirent le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol des phosphoinositides.
Les PI 5-phosphatases de type II comprennent :
- les synaptojanines (SYNJ),
- OCRL1 (Oculo-Cerebro-Renal syndrome of Lowe),
- INPP5B,
- INPP5J/PIPP,
- INPP5K/SKIP.

Vous pouvez lire : The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis (2015) et Phosphatidylinositol Kinases and Phosphatases in Entamoeba histolytica (2019).
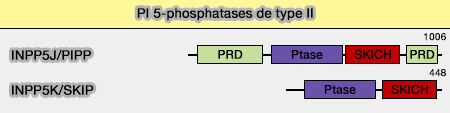
INPP5J/PIPP
Structure de INPP5J/PIPP
1. INPP5J est également appelé inositol polyphosphate 5-phosphatase riche en proline (PIPP) en raison des deux régions riches en proline aux extrémités N- et C-terminales de la protéine.
(Figure : vetopsy.fr d'après Nakada-Tsukui et coll)
La région N-terminale riche en proline de INPP5J contient :
- un domaine riche en proline (PRD),
- un motif supposé de liaison SH3 (PRSPSR),
- six motifs de liaison 14-3-3, qui la capacité de se lier à une multitude de protéines de signalisation, comme les kinases, les phosphatases, et les récepteurs transmembranaires.
Le domaine catalytique 5-Ptase comprend une extrémité C-terminale globalement conservée à la fois dans PIPP et SKIP.
Le domaine SKICH (SKIp Carboxyl Homology) est responsable de la localisation à la membrane plasmique (Identification of a Novel Domain in Two Mammalian Inositol-polyphosphate 5-Phosphatases That Mediates Membrane Ruffle Localization: the inositol 5-phosphatase SKIP localizes to the endoplasmic réticulum and translocates to membrane ruffles following epidermal growth factor stimulation 2003 et Mechanistic insights into the interactions of NAP1 with the SKICH domains of NDP52 and TAX1BP1 2018).
La région C-terminale contient un domaine riche en proline (PRD).
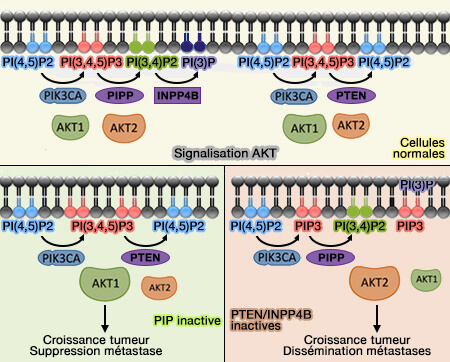
(Figure : vetopsy.fr d'après Toker et Rameh)
2. INPP5J retire le groupe phosphate de l'hydroxyle 5 du noyau de l'inositol de PI(4,5)P2 ou PIP2, PI(3,4,5)P3 ou PIP3, Ins(1,4,5)P3 et Ins(1,3,4,5)P4.
Rôles de INPP5J/PIPP
INPP5J, localisé dans les replis membranaires ou ruffles, jouerait un rôle comme :
- régulateur négatif du développement de la projection des neurones (The Inositol Polyphosphate 5-Phosphatase, PIPP, Is a Novel Regulator of Phosphoinositide 3-Kinase-dependent Neurite Elongation 2006),
- suppresseur de tumeur, en particulier du sein, par son action sur la voie PIK3/Akt (PIPPing on AKT1: How Many Phosphatases Does It Take to Turn off PI3K? 2015).
INPP5K/SKIP
Structure de INPP5K/SKIP
1. INPP5K ou SKIP (Skeletal muscle- and Kidney-enriched Inositol polyphosphate Phosphatase), se trouve principalement dans les muscles squelettiques et les reins, mais aussi dans le cerveau.

(Figure : vetopsy.fr d'après Nakada-Tsukui et coll)
Sa structure comporte :
- un domaine catalytique 5-Ptase
- un domaine SKICH unique à l'extrémité C-terminale [54, 55].
2. SKIP préfère PI(3,4,5)P3 ou PIP3 , mais peut également déphosphoryler PI(4,5)P2 ou PIP2, Ins(1,4,5)P3 et Ins(1,3,4,5)P4.
3. SKIP est situé :
- principalement dans le réticulum endoplasmique (RE) des cellules au repos, où il est lié à la membrane cytosolique par GRP78 (ou BIP, Binding immunoglobulin protein) luminal.
- dans les replis membranaires ou ruffles où il régule négativement l'assemblage du cytosquelette d'actine.
Rôles de INPP5K/SKIP
1. Dans le réticulum endoplasmique (RE), INPP5K est préférentiellement localisé dans des tubules nouvellement formés qui poussent le long des pistes de microtubules et pourrait réguler finement l'organisation du RE (The inositol 5-phosphatase INPP5K participates in the fine control of ER organization 2018).
-
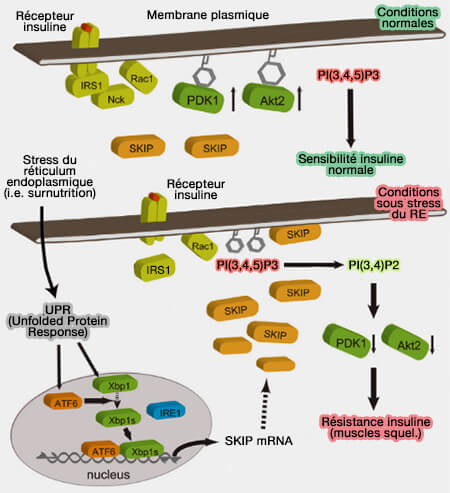
Modèle de résistance à l'insuline par le stress du RE
(Figure : vetopsy.fr d'après Ijuin) - L'épuisement de l'INPP5K ou de l'ARL6IP1 entraîne une augmentation du nombres des feuilles du RE (Phosphoinositide 5-phosphatases SKIP and SHIP2 in ruffles, the endoplasmic reticulum and the nucleus: An update 2020)
2. En outre, INPP5K joue aussi un rôle dans (The Phosphoinositide 5-Phosphatase inpp5k: From Gene Structure to in Vivo Functions 2020 ) :
- la différenciation des myoblastes et l'osmorégulation rénale,
- l'organisation du cytosquelette, l'adhésion cellulaire et la migration, et donc aussi le cancer.
Une mutation de NPP5K a été détecté chez les patients présentant une forme rare de dystrophie musculaire congénitale récessive autosomique (Mutations in INPP5K Cause a Form of Congenital Muscular Dystrophy Overlapping Marinesco-Sjögren Syndrome and Dystroglycanopathy 2017).
3. SKIP régule la signalisation de l'insuline en contrôlant l'absorption du glucose dans le muscle squelettique (Regulation of insulin signaling in skeletal muscle by PIP3 phosphatase, SKIP, and endoplasmic reticulum molecular chaperone glucose-regulated protein 78 2015)
- Suite à la stimulation par l'insuline, SKIP se déplace vers la membrane plasmique par le remplacement de GRP78 (ou BIP) par PAK1 activé qui relie INPP5K au complexe de protéines associé au récepteur de l'insuline (The inositol 5-phosphatase INPP5K participates in the fine control of ER organization 2018).
- SKIP déphosphoryle PI(3,4,5)P3 ou PIP3 à la place de GRP78, réduit l'activation d'AKT2, de la P70 S6 Kinase et de la glycogène synthase.
- SKIP provoque la translocation de GLUT4 (GLUcose Transporter type 4), forme des replis membranaires ou ruffles et inactive la signalisation de l'insuline (A PIP3 phosphatase SKIP links endoplasmic reticulum stress in skeletal muscle to insulin resistance 2015).
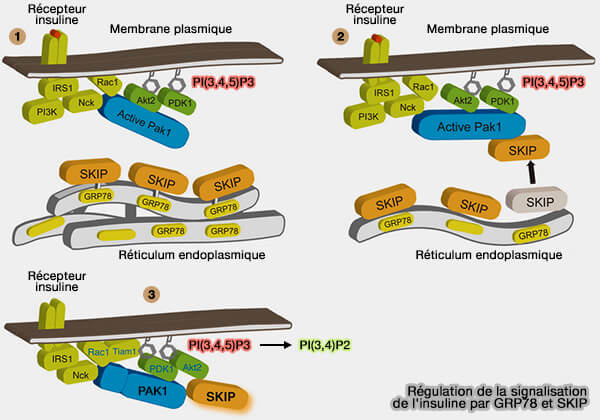
(Figure : vetopsy.fr d'après Ijuin et coll)
Phosphoinositide 5-phosphatases de type III
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesHydrolasesPeptidases/protéasesPhosphatasesProtéine phosphatasesPI phosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


