Composés inorganiques
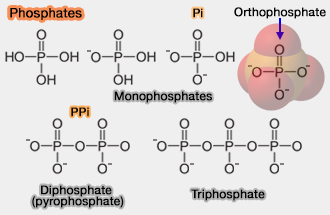
Phosphates
- En construction
En biologie, le phosphore se trouve sous forme d'ion phosphate libre en solution, appelé phosphate inorganique ($\ce{Pi}$), pour le distinguer des phosphates liés dans divers esters de phosphate.
Ions phosphate
1. L'ion phosphate en lui-même de formule brute $\ce{-PO4^3-}$ comprend un atome de phosphore central entouré par quatre atomes d'oxygène formant un tétraèdre et contenant trois charges négatives.
L'acide phosphorique comporte, dès lors, des bases conjuguées :
- $\ce{H3PO4}$ $\leftrightharpoons$ $\ce{H+ +\,H2PO4^-}$ (dihydrogénophosphate),
- $\ce{H2PO4^-}$ $\leftrightharpoons$ $\ce{H+ +\,HPO4^2-}$ (hydrogénophosphate),
- $\ce{HPO4^2-}$ $\leftrightharpoons$ $\ce{H+ +\,PO4^3-}$ (orthophosphate ou phosphate).
(Figure : vetopsy.fr)
2. Dans les limites physiologiques du pH (
- On l'appelle, en général Pi mais, dans la plupart des cas, les scientifiques gardent ce nom que pour $\ce{HPO4^2-}$.
- PI est un sigle courant avec d'autres significations, comme par exemple phosphoinositides.
Estérification des ions phosphate
Les phosphates subissent des réactions chimiques dont la plus importante est sans doute l'estérification qui conduit aux organophosphates ou esters phosphate, qui constituent :
- les acides nucléiques, nucléosides et nucléotides,
- de nombreux cofacteurs essentiels à la vie,
- des molécules toxiques pour l'organisme.
1. L'estérification, remplacement d'un groupe hydroxyle ($\ce{-OH}$), par un groupe alcoxyle ($\ce{-O-R'}$), appelé aussi alkoxy, , groupe alkyle (alkane ayant perdu un atome d'hydrogène) lié à l'oxygène, $\ce{R-O}$.
En général, cette estérification du phosphate se fait par un alcool ($\ce{R-OH}$), un énol ($\ce{C=C−OH}$), un phénol ($\ce{-C6H5-OH}$), …
(Figure : vetopsy.fr d'après Viaud et coll)
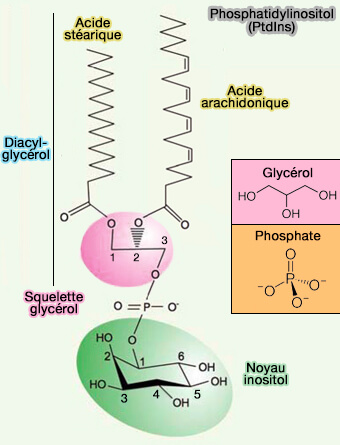
2. Une estérification double est à l'origine de la liaison phosphodiester, i.e. liaison entre deux des groupes hydroxyles de l'acide phosphorique avec deux groupes hydroxyles de deux autres molécules pour former deux liaisons ester.
C'est le cas par exemple des phosphoinositides, et leur molécule de base, le phosphatidylinositol (PtdIns).
Polymères de phosphate
Les phosphates peuvent former des polymères :
1. Les pyrophosphates ou diphosphates ou PPi, i.e. $\ce{P2O7^4-}$, sont formés dans les cellules par l'hydrolyse de l'ATP en AMP.
$\ce{ATP}$ $\leftrightharpoons$
$\ce{AMP + PPi}$
Le pyrophosphate libéré est hydrolysé très rapidement par la pyrophosphatase inorganique (EC 3.6.1.1) PPi est instable en solution aqueuse et se décompose.
$\ce{PPi + H2O}$ $\longrightarrow$ $\ce{2Pi}$
a. Le pyrophosphate est un anhydride (qui a perdu des molécules d'H2O), i.e. composé de deux groupe acyle ($\ce{-C(=O)-}$) liés par le même oxygène résultant de la réaction chimique entre deux acides, dans ce cas là deux phosphates.
b. Les phosphates peuvent aussi se lier à des acides carboxylique ($\ce{-C(=O)OH}$.
Remarque : l'hydrolyse des les liaisons phosphoanhydrides (ou pyrophosphates) $\ce{P-O-P}$ sont des liaisons riches en énergie (
2. Les triphosphates, i.e. $\ce{P4O10^5-}$, sont des phosphates à haute énergie ou high-energy phosphate (
Le clivage de leur liaison par hydrolyse libère une importante quantité d'énergie (

Biologie cellulaire et moléculaireConstituants de la celluleMatrice extracellulaireReproduction cellulaireBiochimieChimie organiqueBioénergétiqueProtidesAcides aminésProtéinesGlucidesLipidesEnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


