Enzymes
Groupe des hydrolases (EC 3)
Phosphatases : lipide phosphatases
Phosphatidylinositol 3-phosphatases (PI 3-phosphatases)
TPIP et myotubularines
(MTM)
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Enzymes
- Vue d'ensemble
- Classification des enzymes
- Oxydoréductases (EC 1)
- Transférases (EC 2)
- Hydrolases (EC 3)
- Lyases ou synthases (EC4)
- Isomérases (EC5)
- Ligases ou synthétases (EC 6)
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

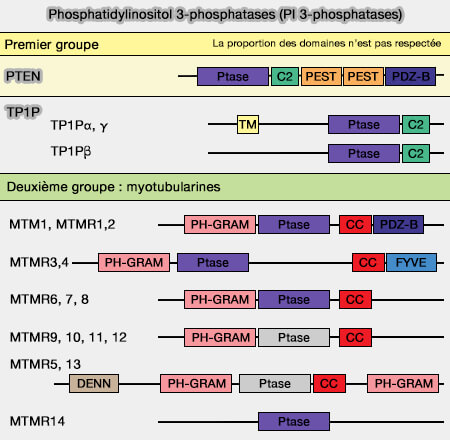
Les PI 3-phosphatases sont des phosphatidylinositol phosphatases (PI phosphatases) qui retirent le groupe phosphate de l'hydroxyle 3 du noyau de l'inositol des phosphoinositides.
1. Dans le même groupe que PTEN (phosphatase and tensin homolog located on chromosome TEN), on trouve TPIP (TPTE and PTEN homologous Inositol lipid Phosphatase).
Remarque : un troisième membre, TPTE (Transmembrane Phosphatase with Tensin Homology), n'a pas d'activité phosphatase : son rôle fonctionnel est obscur, même si TPTE est associée) à certains cancers comme celui de la prostate ou des poumons.
2. Le deuxième groupe comprend les myotubularines (MTM).

Vous pouvez lire : The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis (2015) et Phosphatidylinositol Kinases and Phosphatases in Entamoeba histolytica (2019).
Le centre catalytique des deux groupes de PI 3-phosphatases contient le motif CX5R, également présent dans les protéines tyrosine phosphatases (
TPIP
TPIP (TPTE and PTEN homologous Inositol lipid Phosphatase), une PI 3-phosphatase moins spécifique que PTEN pour le choix des phosphoinositides, se présente sous trois isoformes (TPIP : a novel phosphoinositide 3-phosphatase 2001).
1. TPIPα et γ sont localisés sur les membranes internes, en particulier du réticulum endoplasmique (RE), dans les cellules des testicules, du cerveau et de l'estomac.
Leur structure comprend, comme PTEN, :
- un domaine phosphatase dont le motif CX5R est CKGGKGR et un domaine C2,
- deux ou trois domaines transmembranaires partiels dans leur région N-terminale.
Par contre, il ne possède pas d'extrémité C-terminale phosphorylable.
2. TPIPβ ne possède ni l'extrémité C-terminale de PTEN, ni le domaine transmembranaire de TPIPα/γ et est exprimé d'une manière spécifique dans les testicules.
-
Phosphatidylinositol 3-phosphatases (PI 3-phosphatases)
(Figure : vetopsy.fr d'après Nakada-Tsukiu et coll) - Il n'a aucune activité phosphoinositide phosphatase mesurable.

Le rôle physiologique des TPIP est encore obscur !
Myotubularines
(MTM)
La famille de la myotubularine (MTM), conservée depuis la levure jusqu'à l'homme, se compose de 15 membres :
- MTM1, identifié en premier dans une mutation chez les patients atteints de myopathie centronucléaire ou myotubulaire liée à l'X,
- MTMR (MTM related) 1 à 14.
Structure
Les MTM sont classées en six groupes en fonction de la configuration de leur domaine et de leur activité catalytique :
- MTM1 et MTMR1 et 2,
- MTMR3 et 4,
- MTMR 5 et 13,
- MTMR6, 7 et 8,
- MTMR9, 10, 11 et 12
- MTMR14.
1. À part MTMR14, toutes les MTM possèdent un domaine PH-GRAM (Pleckstrin Homology-Glucosyltransferase, Rab-like GTPase Activator et Myotubularin), impliqué dans la liaison avec les phosphoinositides (Specificity of the Myotubularin Family of Phosphatidylinositol-3-phosphatase Is Determined by the PH/GRAM Domain 2006).
-
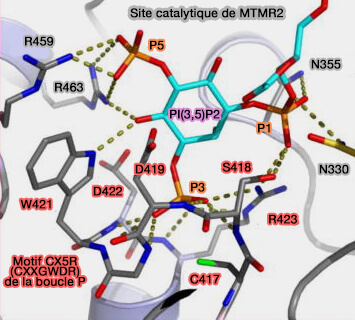
Site catalytique de MTMR2
(Figure : vetopsy.fr d'après Hsu et Mao) - Il est connecté au domaine phosphatase par un lien de 20 résidus.
2. Leur domaine phosphatase est de type CX5R, comme tous les membres de la famille des PI 3-phosphatases (The structure of phosphoinositide phosphatases: Insights into substrate specificity and catalysis 2015).
- Le motif CX5R dans les MTM (CXXGWDR) est différent de celui de PTEN (CKAGKGR).
- Les MTM déphosphorylent préférentiellement PI(3)P et PI(3,5)P2, contrairement à PTEN qui préfère PI(3,4,5)P3 ou PIP3 et PI(3,4)P2 comme substrats.
Toutefois, MTMR5 et MTMR 9, 10, 11, 12 et 13 ont substitué les résidus cystéine et arginine conservés dans le motif CX5R par d'autres acides aminés.
- Ces MTM sont catalytiquement inactifs.
- Ils peuvent s'hétérodimériser avec des MTM actifs, i.e. ils pourraient réguler l'activité et la localisation des MTM actifs
3. Un domaine coiled-coil (CC) est impliqué dans l'homo- ou hétérodimérisation (Systematic analysis of myotubularins: heteromeric interactions, sub-cellular localisation and endosome related functions 2006).
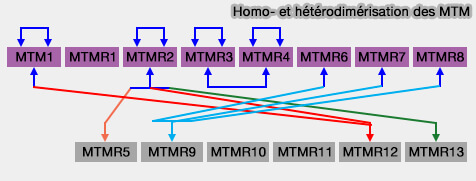
(Figure : vetopsy.fr d'après Hnia et coll)
4. Chez certains membres, on trouve d'autres domaines :
- un domaine PDZ C-terminal dans MTM1 et MTMR1 et 2, pour la liaison avec d'autres protéines,
- un domaine FYVE C-terminal dans MTMR3 et 4 (Analysis of phosphoinositide binding domain properties within the myotubularin-related protein MTMR3 2005),
- un domaine DENN N-terminal qui interagit directement ou indirectement via les RILP avec les petites GTPases de la famille Rab et fonctionne en tant que facteurs d'échange de nucléotides guanidiques, et un autre domaine PH-GRAM C-terminal dans MTMR 5 et 13 (DENN Domain Proteins: Regulators of Rab GTPases 2011 et Discovery of novel DENN proteins: implications for the evolution of eukaryotic intracellular membrane structures and human disease 2012).
Rôles des MTM
1. Le rôle des MTM et de leurs substrats préférés, i.e. PI(3)P et PI(3,5)P2 jouent un rôle dans :
- l'endocytose,
- le trafic membranaire (Structural insights into the centronuclear myopathy-associated functions of BIN1 and dynamin 2 2016).
2. En outre, elles pourraient intervenir dans les processus cellulaires :
- la prolifération et la différenciation cellulaires,
- l'autophagie,
- la phagocytose,
- le positionnement des organites,
- la cytokinèse,
- le réarrangement du cytosquelette et la dynamique des jonctions cellulaires (Myotubularin phosphoinositide phosphatases: cellular functions and disease pathophysiology 2012 et Skeletal Muscle Pathology in X-Linked Myotubular Myopathy: Review With Cross-Species Comparisons 2016).
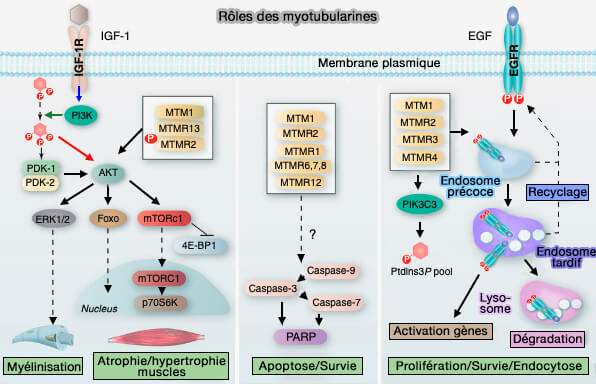
(Figure : vetopsy.fr d'après Hnia et coll)
3. Les fonctions cellulaires des MTM dépendent de leurs protéines de liaison dans les tissus spécifiques et n'impliquent pas forcément leur activité phosphatase.
Par exemple, perturber l'interaction entre MTM1 et son filament intermédiaire, la desmine, composant des sarcomères des cellules musculaires, provoque la formation d'agrégats de desmine, et cette altération est associée aux myopathies myofibrillaires et aux cardiomyopathies (Myotubularin controls desmin intermediate filament architecture and mitochondrial dynamics in human and mouse skeletal muscle 2011).
Phosphatidylinositol 4-phosphatases
(PI 4-phosphatases) : INPP4 et TMEM55
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesEnzymesKinasesHydrolasesPeptidases/protéasesPhosphatasesProtéine phosphatasesPI phosphatasesEstérasesLipasesPhospholipasesATPasesGTPasesProtéines GPetites GTPasesFamille dynamineCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculaires


