Trafic vésiculaire
GGA (Golgi-localized γ-ear containing Arf binding)
- Biologie cellulaire et moléculaire
- Constituants de la cellule
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

Les trois GGA (Golgi-localized γ-ear containing Arf binding) sont des protéines adaptatrices de la clathrine localisées au niveau du réseau trans-Golgi (TGN) et des endosomes.
Structure des GGA
Les trois GGA (GGA1, 2 et 3) sont, contrairement aux adaptines, monomériques.
Les GGA possèdent 4 domaines.
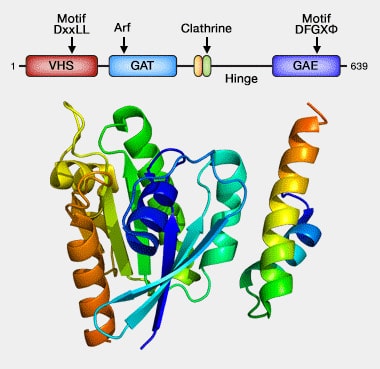
(Figure : vetopsy.fr d'après Emw)
1. Le domaine VHS (Vps27p/Hrs/Stam) N-terminal est impliqué dans l'endocytose et la reconnaissance du peptide signal.
Ce domaine est presque identique au domaine ENTH (Epsin N-terminal homology) de l'epsine et au domaine ANTH (AP180/CALM - Clathrin Assembly Lymphoid Myeloid Leukemia -NH2-Terminal Homology) des Hip1.
Le domaine VHS se lie par exemple à PIK1, i.e. la phosphatidylinositol-4 kinase de la levure, pour cibler PI(4)P de la membrane golgienne et le transformer en PI(4,5)P2 ou P2 (Conserved role for Gga proteins in phosphatidylinositol 4-kinase localization to the trans-Golgi network 2017).
2. Le domaine GAT (GGA et Tom1) interagit avec :
- la petite GTPase Arf pour réguler du trafic,
- l'ubiquitine pour le tri des sélecteurs (GAT (GGA and Tom1) Domain Responsible for Ubiquitin Binding and Ubiquitination 2003).
3. La boîte à clathrine est localisée sur la région charnière.
4. Le domaine GAE (Gamma-Adaptin Ear) C-terminal recrute les protéines accessoires.
Fonctions des GGA
Les fonctions des GGA sont encore mal connues (Do GGA adaptors bind internal DXXLL motifs 2012).
Le KO de GGA2, mais pas de GGA1 ou GGA3, est mortel pour les embryons de souris (Analysis of Gga Null Mice Demonstrates a Non-Redundant Role for Mammalian GGA2 during Development 2012).
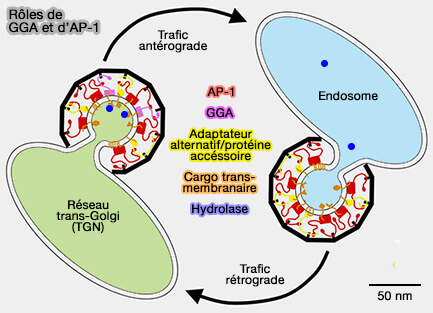
(Figure : vetopsy.fr d'après Hirst et coll)
1. Les GGA interagissent et réglementent le trafic de cargos comme les MPR (Mannose 6-Phosphate Receptors) et la sortiline du réseau trans-Golgi (TGN) aux endosomes.
- Les GGA et AP-1 fonctionnent en coopération dans le tri des MPR et de leurs enzymes lysosomales liées dans les vésicules de clathrine liées au TGN (Distinct and Overlapping Roles for AP-1 and GGAs Revealed by the “Knocksideways” System 2012).
- Les GGA et l'AP-1 coopèrent dans la régulation du trafic antérograde à partir du TGN, mais ont des rôles distincts dans le tri endosomal.
2. Les GGA régulent le trafic à partir d'autres compartiments endosomaux.
GGA1 est impliqué dans le recyclage des cargos telles que BACE1 (Beta-site Amyloid precursor protein Cleaving Enzyme 1) des endosomes précoces vers les endosomes de recyclage (GGA1 regulates signal-dependent sorting of BACE1 to recycling endosomes, which moderates Aβ production 2018).
GGA2 interagit avec le récepteur du facteur de croissance épidermique (EGFR) dans les endosomes (GGA2 interacts with EGFR cytoplasmic domain to stabilize the receptor expression and promote cell growth 2018).
L'épuisement de GGA2 conduit à un mauvais tri de l'EGFR vers les lysosomes via les compartiments post-Golgi, indiquant que GGA2 est nécessaire pour maintenir le niveau d'EGFR pendant la croissance cellulaire (GGA2 interacts with EGFR cytoplasmic domain to stabilize the receptor expression and promote cell growth 2020).
GGA3 possède deux sites de liaison pour l'ubiquitine et joue un rôle dans le ciblage des protéines ubiquitinées pour la dégradation lysosomale (Interactions of GGA3 with the ubiquitin sorting machinery 2004).
GGA3 régule le ciblage lysosomal et le renouvellement de BACE1 à mesure que l'épuisement de GGA3 augmente les niveaux intracellulaires de BACE1 et de peptide bêta-amyloïde (Aβ), le principal composant des plaques amyloïdes (Ubiquitin Regulates GGA3-mediated Degradation of BACE1 2010).
Biologie cellulaire et moléculaireConstituants de la celluleTransport membranaireTransports sans mouvements membranairesTransports passifsTransports actifsTransports avec mouvements membranaires : trafic vésiculaireFusion/fission membranaireEndocytoseVoie sécrétoireCanaux ioniquesTransporteursUniportsPompesCo-transporteursMoteurs moléculairesVoies de signalisation



