Canaux ioniques
Canaux TPC (Two-Pore Channels)
- En construction

Les canaux TPC (Two-Pore Channels), sont des canaux ioniques intracellulaires voltage-dépendants et ligand-dépendants sélectifs des cations, de la famille des canaux CNG (Cyclic Nucleotide–Gated).
Structure et isoformes
1. Les TPC contiennent deux tandem à six domaines transmembranaires -TM - (Structural mechanisms of phospholipid activation of the human TPC2 channel 2019).
Ces canaux pourraient être des intermédiaires évolutifs entre :
-
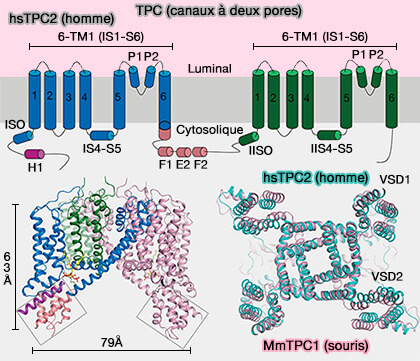
Structure des canaux TPC (Two-Pore Channels)
(Figure : vetopsy.fr d'après Zeng et Coll) - les canaux ioniques voltage-dépendants à 4X6TM, i.e. les canaux CaV et NaV (Two-pore channels provide insight into the evolution of voltage-gated Ca2+ and Na+ channels 2014).
2. On trouve deux isoformes de TCP chez l'homme, exprimés dans les organites acides (On the Structure and Mechanism of Two-Pore Channels 2018).
TPC1, exprimé à la fois dans les endosomes précoces et les lysosomes, seraient sélectifs pour le sodium (Na+).
TPC2, principalement présent sur les membranes lysosomales, serait sélectifs pour le transport des ions Na+, Ca++, et peut-être H+.
Rôle controversé
1. On a longtemps pensé que les TPC sont des récepteurs de NAADP (Nicotinic Acid Adenine Dinucleotide Phosphate) qui médient uniquement la libération du Ca++ lysosomal (NAADP mobilizes calcium from acidic organelles through two-pore channels 2009 et Isolated pores dissected from human two-pore channel 2 are functional 2016).
- La surexpression de TPC a augmenté la liaison du NAADP.
-
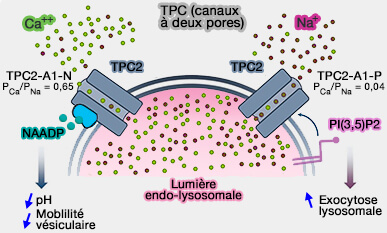
Canaux TPC (Two-Pore Channels)
(Figure : vetopsy.fr d'après Stoklosa et Coll)
Toutefois, il semblerait que TPC2 soit un canal sélectif au Na+ avec une faible perméabilité au Ca++ (Tuning the ion selectivity of two-pore channels 2017).
2. Deux nouveaux agonistes (TPC2-A1-N et TPC2-A1-P) activent TPC2 avec des sélectivités ioniques distinctes, simulant le déclenchement de TPC2 par NAADP ou PI(4,5)P2 ou PIP2 (The name tells the story: Two-pore channels 2020).
Le coefficient de perméabilité (PCa/PNa) est d'environ de :
- 0,65 pour l'activation de TPC2 avec TPC2-A1-N, similaire à PCa/PNa activé par NAADP, ce qui a pour conséquence une diminution du pH endo-lysosomal et une altération de la motilité des vésicules,
- 0,04 pour celle avec TPC2-A1-P, comparable à PCa/PNa activé par PI(4,5)P2 ou PIP2. qui active l'exocytose lysosomale.
3. L'hypothèse unificatrice suppose qu'il faut une (petite) protéine de liaison au NAADP et un canal Ca++ qui est activé par la protéine de liaison au NAADP conjointement avec le NAADP (NAADP: From Discovery to Mechanism 2021).
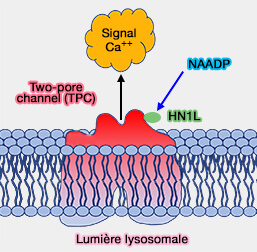
(Figure : vetopsy.fr d'après
Walseth et Coll)
Cette protéine serait HN1L/JPT2, i.e. Haematological and Neurological expressed 1-Like protein/JuPiter microTubule associated homolog 2 (Essential requirement for JPT2 in NAADP-evoked Ca2+ signaling 2021 et HN1L/JPT2: A signaling protein that connects NAADP generation to Ca2+ microdomain formation 2021).
2. Malgré des controverses, les TPC ont des rôles physiologiques importants comme (Acidic calcium stores open for business: expanding the potential for intracellular Ca2+ signaling 2015) :
- la régulation de l'autophagie dans les cardiomyocytes (Endolysosomal two-pore channels regulate autophagy in cardiomyocytes 2016),
- la pigmentation dans les mélanocytes (TPC2 controls pigmentation by regulating melanosome pH and size 2016),
- la régulation de l'infection par le virus Ebola (Two pore channels control Ebolavirus host cell entry and are drug targets for disease treatment 2015),
- l'endurance physique pendant la restriction nutritionnelle (mTOR Regulates Lysosomal ATP-Sensitive Two-Pore Na+ Channels to Adapt to Metabolic State 2013).
En construction


