Messagers intermédiaires
Calmoduline
: structure
- En construction

La calmoduline (CaM ou Calcium-Modulated protein) est une messager intermédiaire multifonctionnelle de liaison aux ions Ca++ exprimée dans toutes les cellules eucaryotes.

(Figure : vetopsy.fr)
La CaM est la cible du Ca++, considéré comme un second messager, dans les processus de transduction du signal intracellulaire dépendant du calcium, qui modifient les interactions avec de nombreuses protéines cibles.
Structure de la CaM
Structure générale
La structure de la CaM, longue de 148 acides aminés, comprend deux domaines globulaires approximativement symétriques, le domaine N-CaM (lobe N) et le domaine C-CaM (lobe C), contenant chacun :
- une paire de mains EF (EF hand) liant les ions Ca++, situés donc aux extrémités N-terminales (CaM1 et 2) et C-terminales (CaM3 et 4), respectivement,
- une région de liaison flexible séparant les deux paires mains-EF (Backbone Dynamics of Calmodulin Studied by 15N Relaxation Using Inverse Detected Two-Dimensional NMR Spectroscopy: The Central Helix Is Flexible 1992).

La région hélicoïdale très flexible permet à la calmoduline de se lier à toute sortes de protéines (

(Figure : vetopsy.fr)
Chaque main EF (12 acides aminés) permet à la calmoduline de détecter les niveaux de calcium intracellulaire en liant un ion Ca++.
- Les régions de liaison aux ions calcium sont situés dans les régions 21-32, 57-68, 94-105 et 130-141.
- Ces régions sont situées entre deux hélices alpha dans les motifs EF-hand, les deux premières régions (21-32 et 57-68) sont d'un côté de la région du lien, les deux autres (94-105 et 130-141) sont de l'autre côté.
Changement conformationnel lié à la liaison du calcium
1. En l'absence de Ca++, le motif hélice-boucle-hélice des mains EF est dans une conformation globulaire dite " fermée " (apo-CaM).
- Ses résidus hydrophobes sont regroupés dans le noyau central.
- Les résidus hydrophiles chargés exposés au solvant.
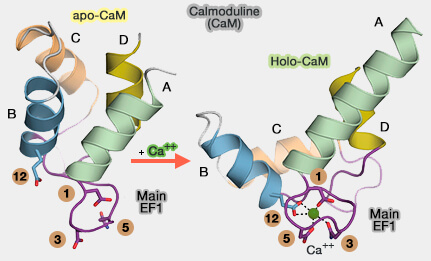
(Figure : vetopsy.fr d'après Iwig et coll)
2. Lors de la fixation du calcium, les hélices se réorganisent en une conformation dite " ouverte " (holo-CaM).
a. Ce changement exposent en surface les résidus hydrophobes qui permettent à la CaM de se lier à ses protéines cibles (
b. Ces deux conformations sont des conformations, semble-t-il, extrêmes.
- La calmoduline peut passer par d'autres configurations.
- Ces différences semble être dues au nombre d'ions qui se lient à la CaM, de 0 à 4.
3. Certaines mutations sur les mains EF de la calmoduline, en particulier le remplacement de l'aspartate (D) par l'alanine (A) en position 1, inhibent la liaison au calcium (Intra- and Interdomain Effects Due to Mutation of Calcium-binding Sites in Calmodulin 2010).
- Ces mutants CaM sont incapables de lier Ca++ sur les deux mains EF du lobe N-terminal (CaM12 avec comme mutations D20A et D56A), les deux mains EF du lobe C-terminal (CaM34, D93A et D129A), ou les quatre mains EF.
- Ces mutations, provoquant des maladies graves, sont liées à des perturbations des liaisons entre les protéines canalaires et la CaM/Ca++(cf. revue dans Calmodulation meta-analysis: Predicting calmodulin binding via canonical motif clustering 2014).
4. Les paires de mains EF aux extrémités N et C-terminales ont des cinétiques de liaison au Ca++ sensiblement différentes, mais elles coopèrent.

(Figure : vetopsy.fr d'après Wang et coll)
a. Les interactions CaM/Ca++ avec leurs cibles sont complexes sur le plan cinétique (A Dynamic Model of Interactions of Ca2+, Calmodulin, and Catalytic Subunits of Ca2+/Calmodulin-Dependent Protein Kinase II 2010 et Dynamic switching of calmodulin interactions underlies Ca2+ regulation of CaV1.3 channels 2013).
- Le lobe C répond bien au Ca++ entrant par le canal sur lequel réside la CaM correspondante (" sélectivité locale au Ca++ ").
- Le lobe N peut, dans certains canaux, nécessiter un signal Ca++ beaucoup plus faible provenant de sources distantes (" sélectivité globale au Ca++ ").
b. L'affinité de la CaM pour ses protéines cibles est augmentée lors de la liaison au Ca++ et son affinité pour le Ca++ est renforcée lors de la liaison de ses protéines cibles.
Les modèles sont nombreux et la recherche est active (Protein recognition and selection through conformational and mutually induced fit 2013 et Dynamics of Nitric Oxide Synthase–Calmodulin Interactions at Physiological Calcium Concentrations 2015 et Structural Consequences of Calmodulin EF Hand Mutations 2017).
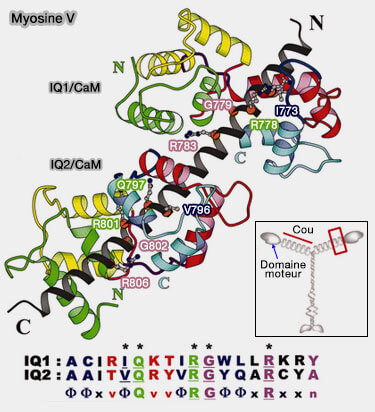
Figure : vetopsy.fr d'après Houdusse)
4. La dissociation des ions Ca++ liés à l'extrémité N-terminale de la CaM précède souvent la dissociation de CaM de ses peptides cibles.
Motifs de liaison
à la calmoduline
1. Les motifs de liaisons à la calmoduline (calmodulin-binding motif) sont nombreux et variés bien qu'ils possèdent certaines caractéristiques communes.

Les motifs de liaison à la calmoduline sont étudiés dans un chapitre spécial.
2. Leur classification distingue :
- les domaines IQ qui se lient à la calmoduline de manière indépendante des ions Ca++,
- d'autres motifs qui dépendent de la liaison de la CaM avec les ions Ca++.
Rôles de la CaM
En construction


