Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Biogenèse
Seipines : partenaires
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

La seipine entrerait en interaction avec de nombreux partenaires qui seraient également impliqués dans le métabolisme lipidique.
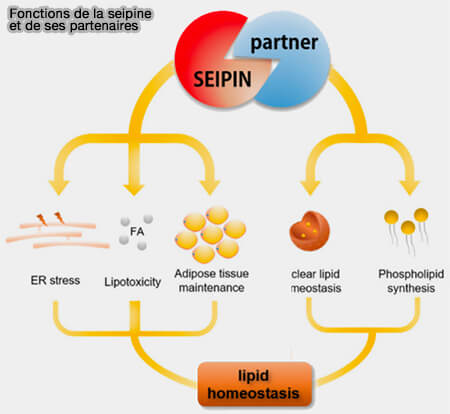
(Figure : vetopsy.fr d'après Jin et coll)
Les partenaires de la seipine sont loin d'être tous identifiés et d'autres partenaires que LDAF1/Lod45/16 interagisse avec elle (SEIPIN: A Key Factor for Nuclear Lipid Droplet Generation and Lipid Homeostasis 2020).
Pex30
Vue d'ensemble
1. Les lipides et les protéines membranaires synthétisés dans le réticulum endoplasmique (RE) sont utilisés pour l'assemblage de novo d'organites, i.e. les gouttelettes lipidiques (LD), mais aussi les peroxysomes dans les MCS ou sites de contact membranaire (
- Les sites de contact membranaire (MCS) sont impliqués dans la facilitation du transfert de lipides synthétisés par le RE pour soutenir la croissance des organites associés (Mechanisms of nonvesicular lipid transport 2021 et The functional universe of membrane contact sites 2020).
- Ces MCS contrôlent également la distribution spatiale des organites et affectent finalement leur héritage dans les cellules filles lors de la division cellulaire (An ER-peroxisome tether exerts peroxisome population control in yeast 2019).
Après l'assemblage, la croissance de ces organites est soutenue par des lipides dérivés du RE transférés au niveau des sites de contact membranaire (MCS).

Vous pouvez lire : Pex30-like proteins function as adaptors at distinct ER membrane contact sites (2021), article qui a servi de trame à ce chapitre.
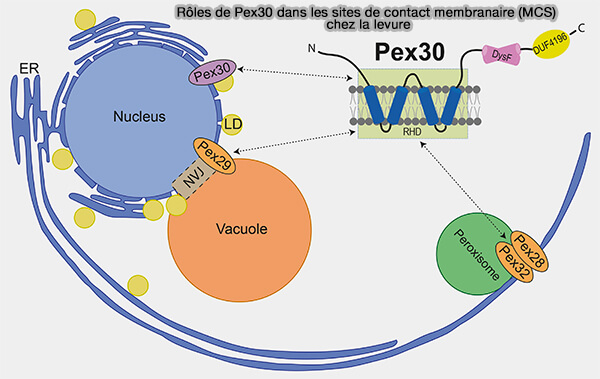
(Figure : vetopsy.fr d'après Ferreira et Carvalho)
2. Chez la levure, Pex30 et les membres de sa famille Pex28, Pex29, Pex31 et Pex32 ciblent et fonctionnent au niveau de plusieurs MCS.
- Pex30 favorise la biogenèse des gouttelettes lipidiques indépendamment des autres membres de la famille.
- Il cible les MCS RE-peroxysomes lorsqu'ils sont liés à Pex28 et Pex32.
- Il organise la jonction nucléaire-vacuolaire (NVJ) lorsqu'ils sont liés à Pex29.
Pex28/Pex32 et Pex29 servent de facteurs de ciblage spécifiques permettant à Pex30 de fonctionner sur différents MCS.
Rôle dans le bourgeonnement
La suppression simultanée de la seipine et Pex30 inhibe largement le bourgeonnement des LD et des PPV, indiquant leurs rôles en partie redondants dans la biogenèse des organelles (Seipin and the membrane-shaping protein Pex30 cooperate in organelle budding from the endoplasmic reticulum 2018).
- Le remodelage de la composition des phospholipides (PL) du réticulum endoplasmique (RE) rétablit le bourgeonnement des organites en l'absence de seipine et de Pex30, soulignant le rôle de la composition membranaire du RE dans la biogenèse des organites.
- Fld1/Sei1 sur la figure ci-dessous est l'homologue de la seipine.
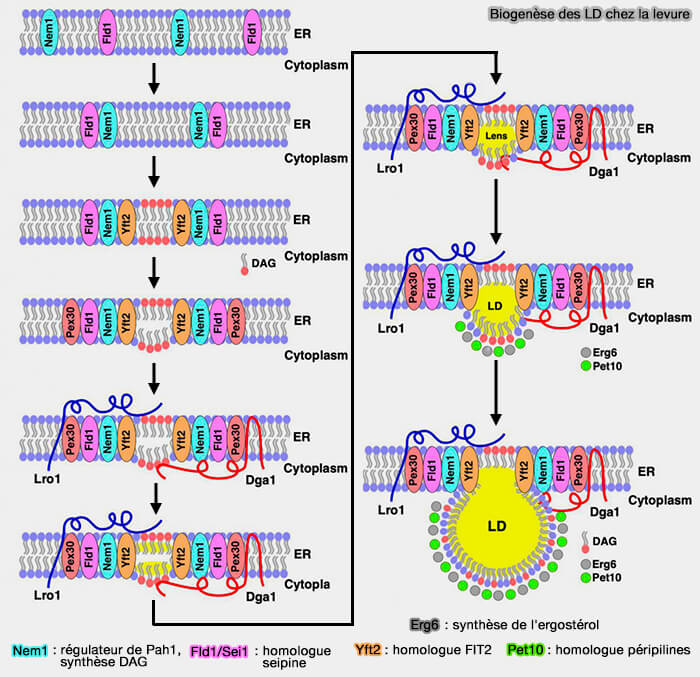
(Figure : vetopsy.fr d'après Choudary et coll)
1. Les protéines de la famille Pex30 s'associent à la membrane du RE via un RHD formé de deux paires de segments transmembranaires rapprochés, RDH connu pour induire une courbure membranaire (A family of membrane-shaping proteins at ER subdomains regulates pre-peroxisomal vesicle biogenesis 2016).
Les RHD sont également présents dans d'autres protéines, telles que les réticulons et les protéines améliorant l'expression des récepteurs, i.e. ils favorisent une courbure membranaire élevée, comme observé dans les tubules du RE ou les vésicules pré-peroxysomales ou PPV (Mechanism of membrane-curvature generation by ER-tubule shaping proteins 2021).
a. Les RHD fonctionnent comme des dimères, et différents dimères induisent des degrés de courbure distincts et le RDH de Pex30 pourrait former des :
- homodimères pour les MCS RE/LD,
- hétérodimères pour les autres MCS.
b. dans le cas des LD, Pex30 pourrait courber la membrane pour faciliter le bourgeonnement.
2. Pex30 possède également un domaine DysF, i.e. domaine impliqué dans les processus de remodelage lipidique.
a. Dans les MCS LD/RE, ce domaine pourrait se lier aux diglycérides (DAG) sur les sites de biogenèse des organites, une activité essentielle (
b. Ce domaine est aussi retrouvé dans une des douze familles de la superfamille des protéines à multiple domaines C2 (MC2D), les ferlines de classe I ou ERTOLD (Crystal structures of the human Dysferlin inner DysF domain 2014 et Functions of Vertebrate Ferlins 2020).
- La famille MCD2 comprend d'autres familles comme celle de Munc13, Piccolo, RIM (Rab3-interacting molecule), les SLP (Synaptotagmin-Like Proteins), les MCTP (multiple C2 domain proteins with two transmembrane regions), les extended synaptotagmines, PI3KC2…
- La mutation de ce domaine provoque des dysferlinopathies chez l'homme.
SERCA (réticulum sarco/endoplasmique Ca2+-ATPase)
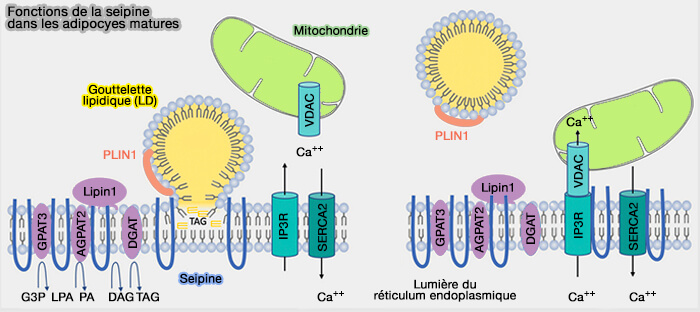
En plus de son rôle dans la biogenèse des LD et le métabolisme des lipides, la seipine se localise sur les sites de contact membranaire (MCS) mitochondriaux (MAM) et intervient dans les flux calciques.
1. SERCA (Sarco/Endoplasmic Reticulum Ca++-ATPase), une pompe à calcium du réticulum endoplasmique (RE) appartenant à la famille des P2-ATPase, est responsable du transport du calcium cytosolique dans la lumière du RE.
Les premières études ont eu lieu chez la drosophile, d'où le terme de dSeipine (Seipin Promotes Adipose Tissue Fat Storage through the ER Ca2+-ATPase SERCA 2014).
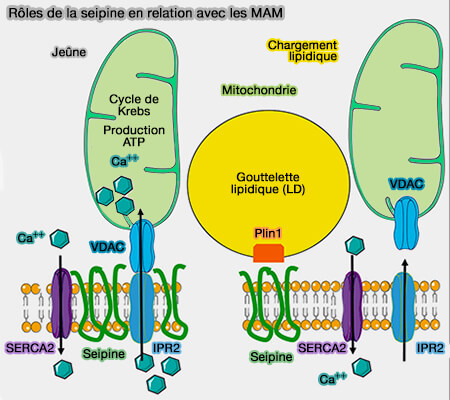
(Figure : vetopsy.fr d'après Combot et coll)
a. La dSeipine interagirait directement avec SERCA via ses hélices centrales hydrophobes.
b. La dSeipine régulerait l'homéostasie intracellulaire du calcium en modulant l'activité de SERCA dans les adipocytes, i.e. les niveaux de calcium sont plus faibles dans le RE et plus élevés dans le cytosol lorsque la seipine est mutée.
- La lipogenèse est régulée négativement et la β-oxydation des acides gras (FA) est plus élevée dans les adipocytes lorsque l'homéostasie du calcium intracellulaire est altérée en raison d'une réduction des taux de calcium dans le RE et d'une augmentation des taux de calcium cytosolique.
- La réduction de la libération de calcium RE-cytosol sauve le mutant dSeipine de la lipodystrophie
2. Lors de déplétion de la seipine chez la souris et l'homme, le flux de calcium vers les mitochondries est réduit, tandis que les réserves de calcium du RE restent initialement intactes (Seipin localizes at endoplasmic-reticulum-mitochondria contact sites to control mitochondrial calcium import and metabolism in adipocytes 2022).
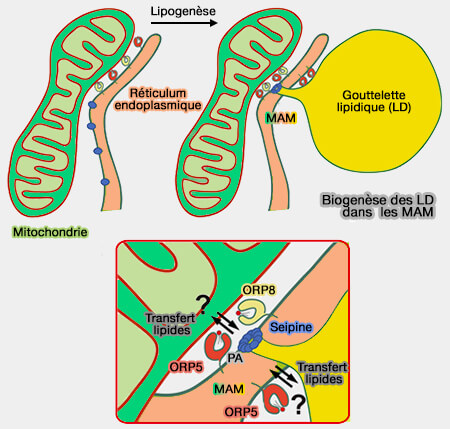
(Figure : vetopsy.fr d'après Guyard et coll)
a. Lors de jeûne, un sous-ensemble de seipines se localise au niveau des sites de contact RE-mitochondries (MAM), à proximité des régulateurs de calcium SERCA et IP3R ou InsP3R, récepteur de l'inositol trisphosphate, ce qui suggère que la seipine pourrait être importante dans la stabilisation des MAM pour le flux de calcium dans les mitochondries.
b. Lors d'excès de lipides, le complexe Orp5/Orp8 se localise sur les sites de contact tripartites RE-MAM-LD nouvellement décrits, dans lesquels il semble que s'effectue le bourgeonnement des LD (ORP5 and ORP8 orchestrate lipid droplet biogenesis and maintenance at ER–mitochondria contact sites 2022).
3. Certaines divergences pourraient être liées à des différences entre les types de cellules.

En conclusion, l'état nutritionnel de la cellule peut affecter l'environnement lipidique des MAM, conduisant au recrutement de la seipine via Orp5, dans laquelle la seipine pourrait être importante pour stabiliser les sous-domaines RE régulant le calcium.
Autres partenaires
D'autres protéines partenaires interagissent physiquement avec la seipine.
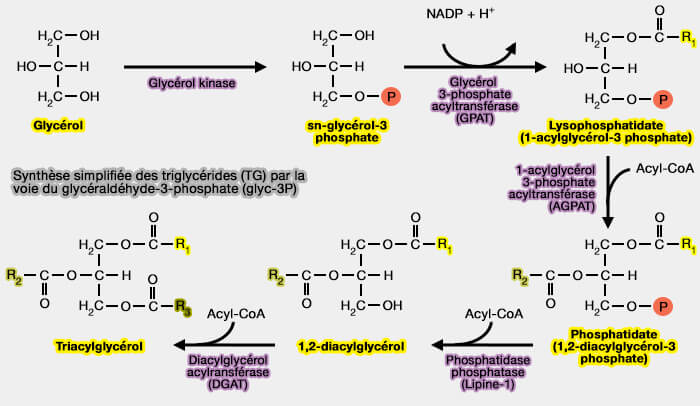
1. La seipine se lie à des enzymes liés à la synthèse des triglycérides :
a. à la phosphatidate phosphatase (lipine-1), homologue de Pah1 de la levure (The human lipodystrophy protein seipin is an ER membrane adaptor for the adipogenic PA phosphatase lipin 1 2013),
En absence de seipine, la lipine-1 n’est plus localisée au RE, i.e. l'acide phosphatidique (PA) ou phosphatidate n’est plus métabolisé et s'accumule.
(Figure : vetopsy.fr d'après Magré et Prieur)
b. à l'acylglycérol-phosphate acyltransférase (AGPAT2), (Seipin oligomers can interact directly with AGPAT2 and lipin 1, physically scaffolding critical regulators of adipogenesis 2015),
- La seipine est capable de lier à la fois la lipine-1 et AGPAT2, ce qui serait au profit d’un contrôle plus fin de la synthèse des triglycérides (TG).
- Les mutations de cet enzyme sont responsables de la BSCL1 (Congenital Generalized Lipoatrophy (Berardinelli-Seip Syndrome) Type 1: Description of Novel AGPAT2 Homozygous Variants Showing the Highly Heterogeneous Presentation of the Disease 2020).
c. à la glycérol-3-phosphate acyltransférase (GPAT3), (SEIPIN Regulates Lipid Droplet Expansion and Adipocyte Development by Modulating the Activity of Glycerol-3-phosphate Acyltransferase 2016),
- L'absence de seipine augmente la production de GPAT3, et donc de PA.
- La surproduction de PA inhibe partiellement PPARγ et altère la différenciation adipocytaire.
- La seipine est aussi capable de lier à la fois à GPAT3 et AGPAT2 (Oligomers of the lipodystrophy protein seipin may co-ordinate GPAT3 and AGPAT2 enzymes to facilitate adipocyte differentiation 2020)

L'absence de seipine conduit à une augmentation de l'acide phosphatidique (PA) cellulaire.
(Figure : vetopsy.fr)
2. La seipine et SCD1 (Stéaoryl-CoA désaturase 1) sont toutes deux localisées dans le RE (Hepatic BSCL2 (Seipin) deficiency disrupts lipid droplet homeostasis and increases lipid metabolism via SCD1 activity 2016),
- La seipine et SCD1 pourrait partie d'un complexe protéique résidant dans le RE qui contrôle la formation de LD, i.e. l'activité SCD serait nécessaire à l'expansion des LD.
- En effet, SDC1 catalyse la transformation des SFA, i.e. acides gras (FA) saturés, en MUFA, monoinsaturés, principalement l'oléate (C18:1) et le palmitoléate (C16:1), qui sont des composants des phospholipides (PL) membranaires, des triglycérides (TG) et des esters de cholestérol (CE) (Loss of stearoyl–CoA desaturase-1 function protects mice against adiposity 2002).
- Le rapport lipidique intracellulaire MUFA/SFA joue un rôle important dans la fusion et l'expansion des LD, ce qui pourrait expliquer le rôle de SCD1.
(Figure : vetopsy.fr d'après Wee et coll)
3. La seipine interagit avec d'autres molécules.
a. La protéine de type réticulon (REEP1) est impliquée dans la formation des tubules (Reep1 null mice reveal a converging role for hereditary spastic paraplegia proteins in lipid droplet regulation 2016).
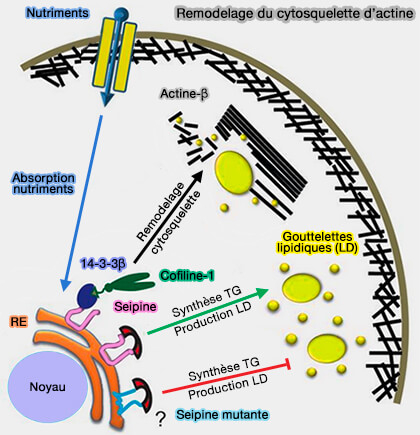
b. La protéine adaptatrice 14-3-3β se lierait aux extrémités N et C-terminales de la seipine (BSCL2/seipin regulates adipogenesis through actin cytoskeleton remodelling 2014 et Towards a mechanistic understanding of lipodystrophy and seipin functions 2014).
- Or, la cofiline, la protéine de fragmentation des microfilaments d'actine, se lie à 14-3-3β.
- La seipine pourrait réguler l'adipogenèse en recrutant la cofiline-1 pour remodeler le cytosquelette d'actine via le 14-3-3β protéine.

La seipine et ses partenaires jouent un rôle essentiel dans le maintien de l’homéostasie lipidique cellulaire (Seipin Deficiency as a Model of Severe Adipocyte Dysfunction: Lessons from Rodent Models and Teaching for Human Disease 2022).
Retour à la seipine ou à la biogenèse des LD
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


