Lipides
Gouttelettes lipidiques
(Lipid droplets ou LD)
Lipolyse adipocytaire
- Biochimie
- Chimie organique
- Bioénergétique
- Composition de la matière vivante
- Composés organiques
- Protides
- Acides nucléiques
- Glucides
- Lipides
- Coenzymes
- Hormones
- Composés inorganiques
- Composés organiques
- Transport membranaire
- Moteurs moléculaires
- Voies de signalisation

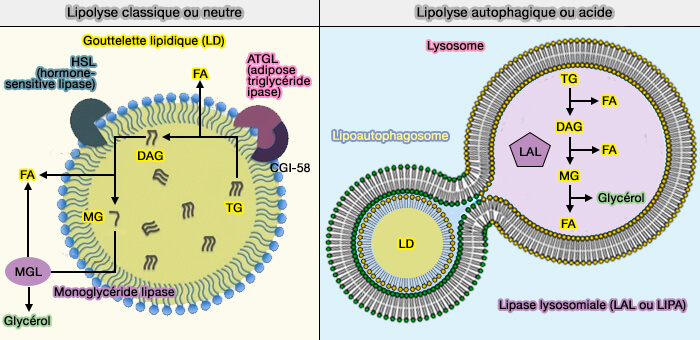
La dégradation des lipides ou lipolyse dans les gouttelettes lipidiques (LD) par les lipases est exprimée par deux processus différents : la lipolyse dite " classique " ou neutre et la lipolyse autophagique ou lipoplyse acide (macrolipophagie ou lipophagie).
Le processus qui mobilise l'énergie, principalement sous forme de triglycérides (TG) stockée pour l'utiliser est appelé (Biochemistry and pathophysiology of intravascular and intracellular lipolysis 2013) :
- lipolyse intracellulaire dans les gouttelettes lipidiques (LD),
- lipolyse intravasculaire dans les lipoprotéines.

Vous pouvez lire : The Lipolysome-A Highly Complex and Dynamic Protein Network Orchestrating Cytoplasmic Triacylglycerol Degradation (2020)
Gouttelettes lipidiques et lipolyse : vue d'ensemble
(Figure : vetopsy.fr)
1. La dégradation des lipides ou lipolyse dans les gouttelettes lipidiques (LD) par les lipases est exprimée par deux processus différents.
- La lipolyse que nous appelerons " classique " ou neutre fait intervenir les lipases qui circulent entre le cytosol ou les surfaces cytoplasmiques du réticulum endoplasmique (RE) et les surfaces des gouttelettes lipidiques.
- La lipolyse autophagique ou lipolyse acide, qui peut être divisée en trois processus différents pour la dégradation des LD dans les lysosomes.

Vous pouvez lire : Lipolysis: cellular mechanisms for lipid mobilization from fat stores (2021).
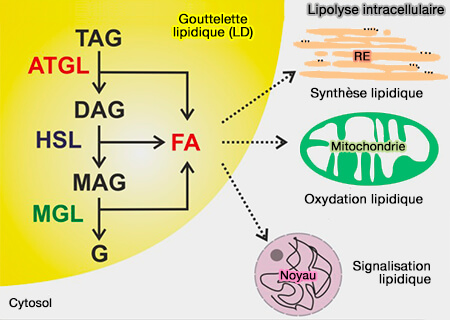
2. La lipolyse est une voie métabolique qui régule l'homéostasie lipidique par les lipases qui circulent entre le cytoplasme ou les surfaces cytoplasmiques du réticulum endoplasmique (RE) et les surfaces des gouttelettes lipidiques.
(Figure : vetopsy.fr d'après Hofer et coll)
Elle permet l'hydrolyse des triglycérides (TG) et la libération d'acides gras (FA).
3. Les acides gras (FA) générés peuvent être utilisés :
a. soit comme substrats pour la production d’énergie par :
- la β-oxydation dans les mitochondries et les peroxysomes,
- la cétogenèse, formation des corps cétoniques, dans le foie.
b. soit comme précurseurs de lipides membranaires ou de molécules de signalisation.
Lipases intervenant dans la lipolyse adipocytaire
La lipolyse fait intervenir des lipases.

Vous pouvez lire : Lipolysis: cellular mechanisms for lipid mobilization from fat stores (2021) qui décrit bien toutes les lipases et leur régulation.
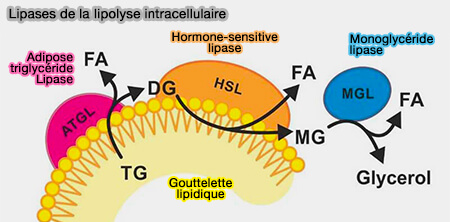
1. Sur les gouttelettes lipidiques, deux lipases sont principalement impliquées.
a. ATGL (Adipose TriGlycéride Lipase) appelée aussi PNPLA2 (PatatiN-like PhosphoLipAse domain-containing protein 2), à la surface des LD, qui convertit les triglycérides (TG) en diglycérides (DAG), i.e. l'enzyme limitante de la lipolyse cytosolique.
$\ce{Triglycéride + H2O}$ $\leftrightharpoons$ $\ce{Diglycéride + acide gras + H+}$
(Figure : vetopsy.fr d'après Cerk et coll)
b. HSL (Hormone-Sensitive lipase), qui subit une translocation vers la LD, pour transformer les diglycérides (DAG) en monoglycérides (MG).
$\ce{Diglycéride + H2O}$ $\leftrightharpoons$ $\ce{Monoglycéride + acide gras + H+}$
2. MGL (monoacylglycérol lipase) est une lipase cytolique qui achève la dégradation en en glycérol et acides gras (FA).
$\ce{Monoglycéride + H2O}$ $\leftrightharpoons$ $\ce{Glycérol + acide gras + H}$
3. LAL (Lipase lysosomale ou LIPA) est une enzyme qui catalyse les trois réaction précédentes dans les lysosomes lors de la lipophagie.

Toutes ces lipases sont étudiées dans des chapitres spécifiques.
Régulation de la lipolyse adipocytaire
Nous ne ferons qu'affleurer ce sujet qui est trop vaste pour vetopsy.fr.

Vous pouvez lire : The Molecular Brakes of Adipose Tissue Lipolysis (2022), article utilisé pour ce chapitre et dans lequel vous trouverez des indications plus précises sur les différents composants.
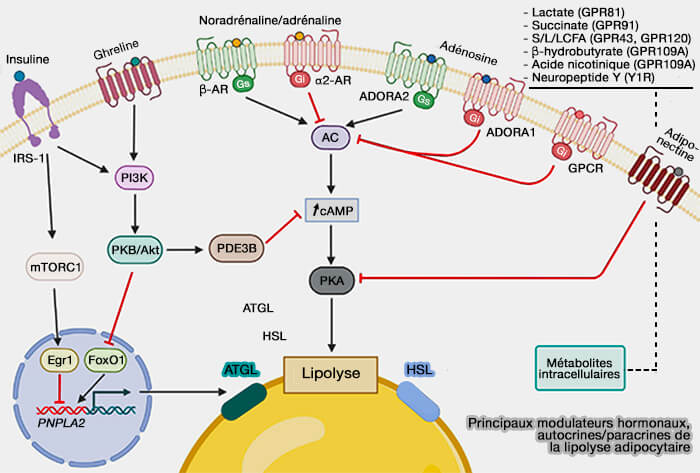
Principaux modulateurs hormonaux, autocrines/paracrines
Les principaux modulateurs hormonaux (endocrines), autocrines et paracrines de la lipolyse adipocytaire sont les suivants.
1. Certains sont anti-lipolytiques.
a. L'inhibition la plus importante est celle de la liaison de l'insuline à son récepteur, IRS-1 (Insuline Receptor Substrate 1) :
- soit par la voie PI3K/Akt provoquant une diminution des taux d'AMPc par la PDE3B (phosphodiestérase 3B), i.e. hydrolysant l'AMPc en 5'AMP (From PDE3B to the regulation of energy homeostasis 2011 et Cyclic Nucleotide Phosphodiesterase 3 Signaling Complexes 2012).
- soit par la voie mTORC1 inhibant la transcription de l'ATGL.
b. D'autres interviennent comme :
- la ghréline, hormone produite par les cellules entéroendocrines du tractus gastro-intestinal, en particulier l'estomac, et qui stimule l’appétit, i.e. agoniste de la leptine, en stimulant aussi la voie PI3K (Ghrelin 2015).
- l'adiponectine, cytokine sécrétée par les tissus adipeux (adipokine) qui exerce des effets protecteurs contre l'inflammation et peut moduler positivement le système endocrinien, en augmentant la sensibilité à l'insuline chez les obèses, en inhibant la PKA via la réduction de sa sous-unité régulatrice RIIα (Adiponectin: Structure, Physiological Functions, Role in Diseases, and Effects of Nutrition 2021).
(Figure : vetopsy.fr d'après Li et coll)
2. En revanche, de nombreuses molécules agissent sur la voie pro-lipolytique de la PKA (Protéine Kinase A ou Protéine Kinase dépendante de l'AMPc), et leurs effets peuvent être positifs ou négatifs selon le récepteur couplé aux protéines G (GPCR) impliqué.
Remarque : les catécholamines et les adénosines ont des effets pro- ou anti-lipolytiques selon le récepteur exprimé.
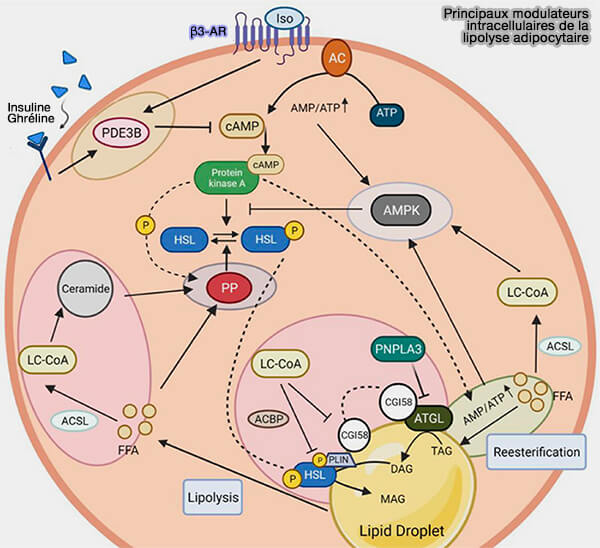
Principaux modulateurs intracellulaires
La figure illustre cinq boucles intracellulaires de mécanisme de rétroaction de la lipolyse adipocytaire.
1. L'insuline, la ghréline et l'isoprénaline, i.e. agoniste non sélectif des récepteurs β-adrénergiques utilisé pour le traitement de la bradycardie régulent l'inhibition de la lipolyse via la dégradation de l'AMPc médiée par la PDE3B (
2.L'AMPK (AMP-activated protein kinase) est impliquée dans la régulation fine de l'activation de de l'AMPc en induisant une boucle de rétroaction négative dans la lipolyse.
- La stimulation de l'AMPK est coordonnée via l'interaction avec les LC-CoA (Long-Chain fatty acyl–CoA), qui résulte de l'activation des acides gras libres (FFA) médiée par l'ACSL (long-chain-fatty-acid-CoA ligase)
- Outre les LC-CoA, la production et la dégradation de l'AMPc ainsi que la réestérification participent à cette induction de l'AMPK en raison d'une augmentation du rapport AMP/ATP produit au cours de ces processus (
charge énergétique de la cellule).
(Figure : vetopsy.fr d'après Li et coll)
3. La PKA peut intervenir dans deux processus.
- Elle peut potentiellement activer la diglycéride acyltransférase (DGAT) pour réestérifier les diglycérides (DAG) en triglycérides (TG).
- La phosphorylation de HSL (Hormone-Sensitive lipase) peut être inhibée par un taux d'AMPK élevé.
4. La phosphorylation de HSL peut être inversée par les PP (Protein Phosphatase), dont l'activation repose fortement sur la présence de FFA et de PKA pour induire un mécanisme de rétroaction.
5. Outre son action sur AMPK et donc sur HSL (voie 2), LC-Coa (Long-Chain fatty acyl–CoA) peut impacter plusieurs voies de régulation.
a. LC-Coa entre dans la voie de biosynthèse des céramides, suivie d'une atténuation de la lipolyse via l'activation de PP2A.
b. LC-CoA a un impact sur la déplétion des protéines lipases (HSL, ATGL).
- LC-CoA inhibe HSL par l'intermédiaire d'ACBP/DBI ou Acyl-CoA-Binding Protein/Diazepam Binding Inhibitor (Acyl-CoA-binding protein (ACBP): a phylogenetically conserved appetite stimulator 2020).
- LC-CoA agit comme un inhibiteur non compétitif d'ATGL, où il se lie à CGI-58/ABHD5 et interagit avec Plin. Le complexe LC-CoA/CGI-58/Plin entraîne la désactivation de l'ATGL.
Remarque : comme LC-CoA, PNPLA3 (patatin-like phospholipase domain-containing protein 3) sert d’inhibiteur compétitif de CGI-58 pour atténuer l’activité catalytique de l’ATGL.
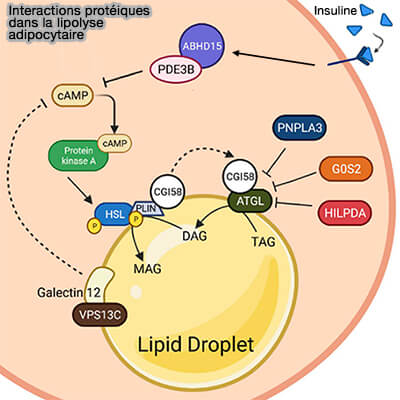
Modulation par interactions protéiques dans la lipolyse adipocytaire
Pour en rajouter une couche, les phosphodiestérases (PDE), les lipases et les protéines d'échafaudage des gouttelettes lipidiques elles-mêmes sont les cibles de régulateur de la lipolyse.
De très nombreux partenaires d'interaction protéique forment de grands complexes macromoléculaires (signalosomes) régulant leur activité endogène.
(Figure : vetopsy.fr d'après Li et coll)
1. La liaison à l'insuline induit la stabilisation de la PDE3B avec CGI-58/ABHD15.
Ce complexe moléculaire favorise la dégradation de l'AMPc, qui inhibe par conséquent la phosphorylation de la HSL lors de l'inactivation de la PKA.
2. Outre HSL, PLIN1 est également directement réglementé par la PKA.
- La stimulation de PLIN1 médie la libération de CGI-58/ABHD5 du complexe PLIN1 et HSL pour se lier à l'ATGL et induire son activité catalytique.
- Néanmoins, le complexe CGI-58 et HSL peut être supprimé par la présence d’inhibiteurs de liaison, G0S2 (G0/G1 switch gene 2), HILPDA (Hypoxia-Induced Lipid Droplet-Associated protein) et PNPLA3.
Remarque : la galectine12, une protéine localisée sur les gouttelettes lipidiques, et son coactivateur, VPSC13, peuvent modifier la production d'AMPc en inhibant la fonction de recrutement de la PDE, ce qui contribue finalement à l'abolition de la lipolyse.
Retour ves les gouttelettes lipidiques (LD)
BiochimieChimie organiqueBioénergétiqueProtidesGlucidesLipidesAcides grasLipides vraisLipides vrais simplesLipides vrais complexesLipoïdesCholestérolGlycéridesPhospholipidesTrafic non vésiculaire et LTPDigestion et absorption entérocytaire des lipidesLipoprotéinesApolipoprotéinesGouttelettes lipidiques (LD)EnzymesCoenzymesVitaminesHormonesComposés inorganiquesTransport membranaireMoteurs moléculairesVoies de signalisation


